Как правильно сделать укол кошке в холку и внутримышечно в домашних условиях
Если питомец серьезно заболел, любящему хозяину приходится учиться делать уколы коту в холку или мышцу. Даже без медицинских навыков эту манипуляцию не сложно освоить. Главное – отбросить все страхи. К тому же это ускорит процесс выздоровления животного и сэкономит расходы семьи (не нужно возить кошку к ветеринару несколько раз в день или платить за пребывание в дневном стационаре).
Узнаем, какие уколы можно делать самому, а в каких случаях манипуляции выполняет только ветеринар.
Общие правила
Зачастую ветеринар назначает кошке курс парентеральных уколов, которые ставят подкожно (в область холки), в мышцу бедра или плечо. Чтобы правильно и без последствий сделать укол кошке (в область холки или мышцу) важно знать несколько правил:
- Можно вводить только теплый раствор (особенно это касается вакцин и препаратов, которые хранят в холодильнике). Лекарство должно быть примерно комнатной температуры.
 Достичь этого можно, если заранее достать флакон (за 2-3 часа до процедуры) или согреть его в теплой воде. Если этим правилом пренебречь и ввести холодный раствор, велика вероятность образования труднорассасываемых инфильтратов.
Достичь этого можно, если заранее достать флакон (за 2-3 часа до процедуры) или согреть его в теплой воде. Если этим правилом пренебречь и ввести холодный раствор, велика вероятность образования труднорассасываемых инфильтратов. - Необходимо приготовить несколько запасных шприцов. Часто приходится набирать жидкость из флакончика с алюминиевой крышкой, а это приводит к образованию зазубрин на игле, что вызывает дополнительную боль у кошки при введении лекарства. Если раствор предварительно был смешан, вязкий или плохо растворился, происходит засорение полости иглы. В таких случаях одной иглой рекомендуется набрать препарат в шприц, затем заменить ее новой.
- Всегда выгонять воздух из полости шприца перед уколом. В противном случае есть риск образования шишки или синяка. Смертельной угрозы этот проступок не принесет, но усложнит дальнейшие инъекции.
Для удаления пузырьков воздуха применяют постукивание пальцем по корпусу шприца или вращающие движения, чтобы собрать все мелкие пузыри в один большой и затем удалить его.
Шприцы бывают разные и иногда крайне сложно убрать все пузырьки. В таком случае при введении раствора необходимо держать поршень шприца вертикально вверх (лекарство уйдет, а воздух останется в шприце).
- Внимательно читать инструкции к назначенным препаратам, особенно если требуется соединить несколько компонентов (например, при вакцинации или создании сложных растворов). В таких процессах важна последовательность смешивания для оптимального растворения.
Если врач назначил несколько уколов в один промежуток времени, то стоит уточнить о возможности соединения растворов вместе. Если это противопоказано, то необходимо колоть с небольшим временным интервалом.
- Менять места инъекций, если их приходится делать часто. Подкожные уколы можно поставить кошке в холку (загривок), в области лопаток или паха. Холка – самая высокая точка тела и находится на позвоночнике между лопатками кошки. Причем кожа на холке гораздо толще и сложнее прокалывается инсулиновым шприцом, чем таковая над лопатками.

Внутримышечные уколы ставятся котам как в заднюю (тазовую), так и в переднюю (грудную) конечность.
- Определять самостоятельно способ введения лекарства, исходя из объема или дозы (это касается только тех лекарств, которые допустимо вводить любым парентеральным способом, минуя ЖКТ). Большие объемы лекарств (свыше 3-5 мл) хорошо вводить кошке в холку (кожа хорошо растягивается и снижается вероятность образования шишек). Растворы в объеме до 3 мл смело можно колоть в лапу, да и действие их проявится немного быстрее.
Например, врач назначил делать уколы коту по 3 мл в область холки или мышцу (точка введения – на усмотрение владельца). Ввод препарата подкожно будет менее болезненным для питомца.
Важно помнить! Воздушные пузырьки занимают некоторый объем, что приводит к погрешности в дозировании средства. Это стоит учитывать при введении малых доз сильнодействующих медикаментов.
Выбор подходящего шприца и иглы
Для выбора шприца важны два фактора: габариты кошки (вес, возраст) и консистенция вводимого препарата. Чем крупнее и толще питомец, тем длиннее должна быть игла. Соответственно взрослым и упитанным котам подойдут шприцы на 2-10 мл.
Чем крупнее и толще питомец, тем длиннее должна быть игла. Соответственно взрослым и упитанным котам подойдут шприцы на 2-10 мл.
Более мелкие шприцы (на 1 мл) можно применять для инъекций кошкам внутримышечно в бедро, но лекарство не должно быть густым.
Для котят и истощенных животных оптимальными будут шприцы на 1 и 2 мл.
Важно! Не рекомендуется на инсулиновый шприц ставить иглу от более крупного шприца, а также наоборот (игла может слететь во время надавливания поршня).
Смена иглы на более тонкую допускается в тех случаях, когда кошке показано подкожное введение 10-20 мл жидкости и более. Для этой манипуляции лучше набрать лекарство в большой шприц и затем сменить иглу.
Важно! Укол коту нужно ставить одноразовым и стерильным шприцом. Нельзя использовать дважды один инструмент во избежание закупорки иглы и смешивания разных препаратов.
Нужно ли обрабатывать кожу антисептиком
Антисептическая обработка места инъекции у кошек с шерстью бесполезна. Манипуляция имеет смысл только для голых пород кошек (сфинкс, эльф, бамбино, кохона, петерболд, украинский левкой).
Манипуляция имеет смысл только для голых пород кошек (сфинкс, эльф, бамбино, кохона, петерболд, украинский левкой).
Глубина введения иглы
Самое важное в процессе выполнения укола кошке – доставить лекарство строго по показаниям. При инъекции в область холки – под кожу, а при внутримышечной – в мышцу. Поэтому начинающему «лекарю» стоит потренироваться на куриной тушке.
Укол коту в холку делают не глубже 1-1,5 см. Если перестараться, можно насквозь проткнуть кожную складку, что визуально станет заметно по струйке вытекающего лекарства или намоканию шерсти вокруг. Угол введения иглы при уколе под кожу должен составлять 45 градусов.
Глубину введения внутримышечных инъекций определяют с учетом размеров лапы животного и длины иглы. Ориентировочно игла вводится на половину или 2/3. Не стоит втыкать иглу полностью, она может сломаться и уйти в толщу мышечных волокон. Правильный угол наклона шприца – 90 градусов к поверхности кожи.
Внимание! Проводить манипуляцию нужно уверенно и быстро, так как кошка испытывает болезненные ощущения.
Она будет громко выражать недовольство и попытается сбежать любыми способами. Поэтому ветеринары советуют перед уколами обязательно стричь когти и надежно фиксировать даже очень спокойного кота.
Скорость введения лекарства
В описаниях к лекарственным препаратам иногда указывается скорость его введения (особенно если препарат тягучий или вязкий).
Правильная фиксация
Для надежного удержания кошки подходят:
- фиксирующая сумка – отличное и полезное изобретение для строптивых животных, она позволяет осуществлять различные манипуляции (уколы в холку и ногу, подстригание когтей, осмотр пасти) и защитит человека от острых когтей и зубов кошки;
- плотное одеяло или полотенце, в которое пеленают кошку;
- крепкий помощник, которому необходимо одной рукой захватить передние лапы животного, а второй – задние.
Если питомец спокойный или находится в угнетенном состоянии, то вполне достаточно будет поставить кошку на четыре лапы на пол или стол, попросить помощника удерживать ее за холку и заднюю ногу до завершения процедуры.
Техника подкожной инъекции
После фиксации кошки и подготовки шприца, нужно сделать следующее:
- двумя пальцами сформировать крупную складку кожи в области холки или около лопатки;
- аккуратно ее оттянуть и удерживать;
- вонзить иглу у основания кожи под углом 45° до ощущения «проваливания в пустоту», примерно на половину длины;
- плавно ввести лекарство;
- извлечь иглу;
- расправить кожу холки;
- сделать легкий массаж.
Когда укол ставят в холку котенку, то иглу нужно вводить осторожно и неглубоко, иначе можно попасть в мышцы шеи. При правильном попадании в подкожное пространство жидкость будет легко выходить из шприца, образовывая мягкий шарик, который рассосется за несколько минут.
Агрессивной или пугливой кошке укол подкожно необходимо делать только после проверки ее ветеринарного паспорта на наличие штампа о вакцинации против бешенства. Потому что при кошачьих укусах человек может заразиться этим опасным вирусом.
Как сделать внутримышечный укол кошке
Внутримышечная инъекция — еще один вид парентерального введения сложных растворов (эмульсии, суспензии), когда препарат проникает непосредственно в мышцу.
Кошкам внутримышечно уколы делают в заднюю часть бедра и в плечо. Взрослым кошкам максимально вводится до 2 мл, для котят дозировка в два раза меньше.
Алгоритм действий для совершения укола в мышцу:
- обездвижить кошку;
- подготовить шприц;
- разогнуть конечность, постараться расслабить кошку;
- нащупать мышечный валик и быстро ввести иглу под углом 90°, примерно на 2/3 длины;
- плавно нажать на поршень шприца, выдавить содержимое;
- удалить иглу и слегка помассировать конечность.
Важно! Манипуляцию совершать нужно настолько быстро, насколько это возможно, чтобы животное не испытывало стресс. Полезно будет после укола приласкать кошку и угостить ее любимым лакомством.

Возможные ошибки и как их избежать
Иногда после совершения инъекций кошкам в домашних условиях появляются осложнения, которые возникают из-за типичных ошибок новичков:
| Последствия уколов в холку | Причина | Что делать |
|---|---|---|
| Шишка долго не проходит (инфильтрат или абсцесс) | Был введен препарат с раздражающим действием, который запрещено вводить под кожу | Обратиться к ветеринарному врачу, он возьмет пункцию экссудата и назначит лечение |
| Поредение шерсти, алопеции | Повышенная чувствительность кошки к частым процедурам, стрессовое состояние, возможна аллергическая реакция | Проконсультироваться с ветеринаром |
| Липодистрофия (образование ямок на коже в местах введения гормональных средств) | При частом введении гормональных препаратов (Инсулин, Ковинан) активные вещества разрушают жировую ткань в месте укола | Чередовать точки уколов |
| Последствия внутримышечного введения | ||
| Синяк | Воздух в шприце, который проник в капилляр и вызвал его закупорку.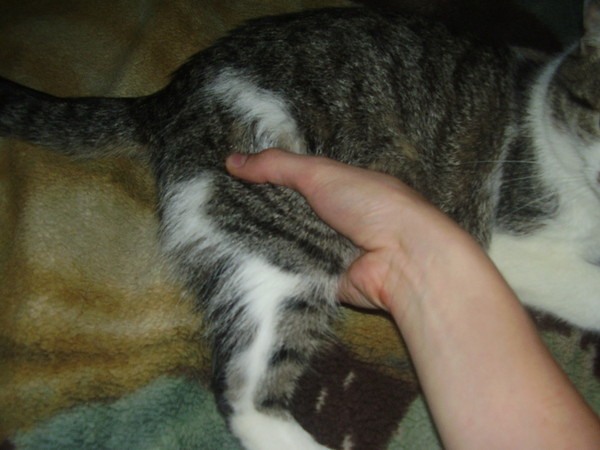 Или был поврежден капилляр, произошло небольшое кровотечение Или был поврежден капилляр, произошло небольшое кровотечение | Никакой угрозы здоровью животного не будет, но следующую инъекцию придется делать в другую ногу |
| Хромота после укола | Лекарство ввели близко к внутренней поверхности бедра (глубоко вонзили иглу), где проходят нервы. Возникшая болезненность мышцы выражается временной хромотой кошки | Это не опасно и спустя сутки пройдет. Можно делать небольшой массаж |
| Некроз тканей | Использован препарат, который вливается только внутривенно | Обратиться в ветеринарную клинику |
| Нагноение тканей, флегмона | Частые уколы в одно и то же место, особенно густых и вязких (маслянистых) препаратов | Обратиться в ветеринарную клинику |
| Выпадение шерсти вокруг места укола, покраснение кожи | Аллергическая реакция, индивидуальная непереносимость компонентов лекарства | Прекратить инъекции и связаться с лечащим врачом для пересмотра лечения |
Самым неблагоприятным последствием во время домашних неумелых инъекций является излом иглы и проникновение ее внутрь тканей. Это случается при резком движении кошки в момент ввода острия иглы. Самостоятельно извлечь ее практически невозможно. Животное будет испытывать сильную боль при любом движении. Поэтому если такое случилось, нужно срочно обратиться к врачу. В данном случае потребуется рентген и хирургическая операция.
Это случается при резком движении кошки в момент ввода острия иглы. Самостоятельно извлечь ее практически невозможно. Животное будет испытывать сильную боль при любом движении. Поэтому если такое случилось, нужно срочно обратиться к врачу. В данном случае потребуется рентген и хирургическая операция.
Как перестать бояться сделать укол питомцу
Для того чтобы не бояться собственноручно ставить уколы коту, нужно запомнить следующее:
- Если при бедренной инъекции в мышцу игла вонзилась в кость или связку, нельзя паниковать, нужно спокойно оттянуть иглу назад и продолжить манипуляцию. Вреда коту не будет.
- Один маленький пузырек, который проник из шприца под кожу или внутрь мышцы, рассосется самостоятельно, не нанесет ущерба здоровью кошки.
- Если при уколе в холку игла вышла навылет и по шерсти покатились капли лекарства (или брызнул фонтанчик), нужно успокоиться и, немного оттянув иглу назад, ввести остатки раствора.
- Агрессивным котам полезно заранее (до начала курса уколов) приклеить мягкие коготки, чтобы защититься от царапин.
 Эти аксессуары сейчас широко представлены в зоомагазинах и пользуются популярностью среди владельцев. Они крепятся на суперклей и срезаются ежемесячно по мере отрастания когтей. К тому же это отличное средство для защиты мебели, царапать которую кошке будет неудобно.
Эти аксессуары сейчас широко представлены в зоомагазинах и пользуются популярностью среди владельцев. Они крепятся на суперклей и срезаются ежемесячно по мере отрастания когтей. К тому же это отличное средство для защиты мебели, царапать которую кошке будет неудобно. - Если врач назначил кошке много уколов, то стоит запастись всевозможными лакомствами и колбасками, а также успокоительными каплями на травах (например, Кот Баюн).
Для того чтобы сделать укол кошке в холку или мышц, не нужно быть ветеринаром или медиком. Достаточно любить своего питомца, знать особенности его поведения в стрессовых ситуациях и желать ему долгой и счастливой жизни вне ветеринарной клиники.
Мне нравится4Не нравится1
Как сделать укол в холку котёнку, как не надо колоть котёнка — ошибки
Уже с первых месяцев жизни котятам приходится сталкиваться с такой неприятной процедурой, как уколы. Причиной тому и плановая вакцинация, и различные заболевания. Освоить технику постановки подкожных инъекций по силам каждому владельцу котёнка: главное — действовать четко, уверенно и избегать типичных ошибок.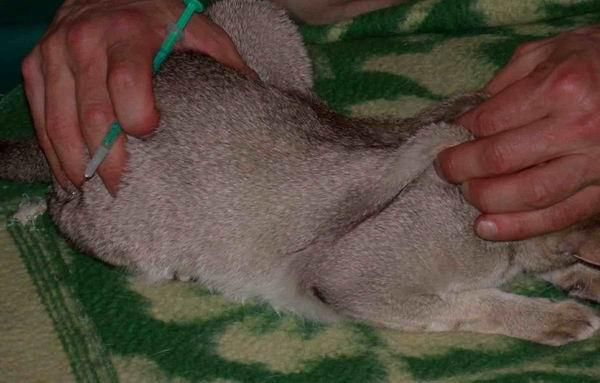
Почему в холку?
Обратите внимание, что кошка-мать перемещает своих детёнышей, удерживая именно за холку. Люди, наблюдающие за этим процессом впервые, очень удивляются, что котята не испытывают никакого дискомфорта.
Дело в том, что кожа на холке толстая и не насыщенная нервными окончаниями, а значит, эта область идеальна для подкожных инъекций. И если сделать укол в холку котёнку правильно, он в буквальном смысле слова ничего не почувствует.
Укол котёнку в холку: основные правила
Конечно, для того чтобы вся процедура была наименее стрессовой, безболезненной и безоасной, необходимо придерживаться следующих правил:
- Лучше всего использовать инсулиновый шприц. Его иголка очень острая и тонкая (диаметр её не превышает 0,3 мм). Правда, объём таких шприцев составляет 1–2 мл, но в большинстве случаев для котят этого хватает.
- Ампулу нужно вскрывать непосредственно перед постановкой укола. Использование раствора из ранее открытой ампулы, а также повторное применение одноразовых шприцев запрещено.

- Место введения обрабатывать спиртом не нужно, достаточно тщательно вымыть руки перед процедурой.
- После набора препарата не забудьте выпустить воздух из шприца: для этого переверните его иглой вверх и слегка надавите на поршень, чтобы вылилась капелька жидкости.
- Перед тем, как колоть в холку котёнка, зафиксируйте его в лежачем положении.
- Свободной рукой оттяните кожу чуть выше места схождения лопаток.
- Резким движением введите иглу в центр образованного кожей кармана (параллельно позвоночнику животного под углом 45 градусов).
- Введите лекарство и аккуратно извлеките иглу, не смещая её вправо и влево.
Распространённые ошибки
Если вы направите иголку вниз и введёте чересчур глубоко, есть риск поцарапать мышечные ткани и причинить питомцу сильную боль. Иногда случается, что кожу прокалывают насквозь, и раствор выливается на шерсть.
Чтобы избежать вышеперечисленных проблем, не стремитесь к слишком глубокому проколу.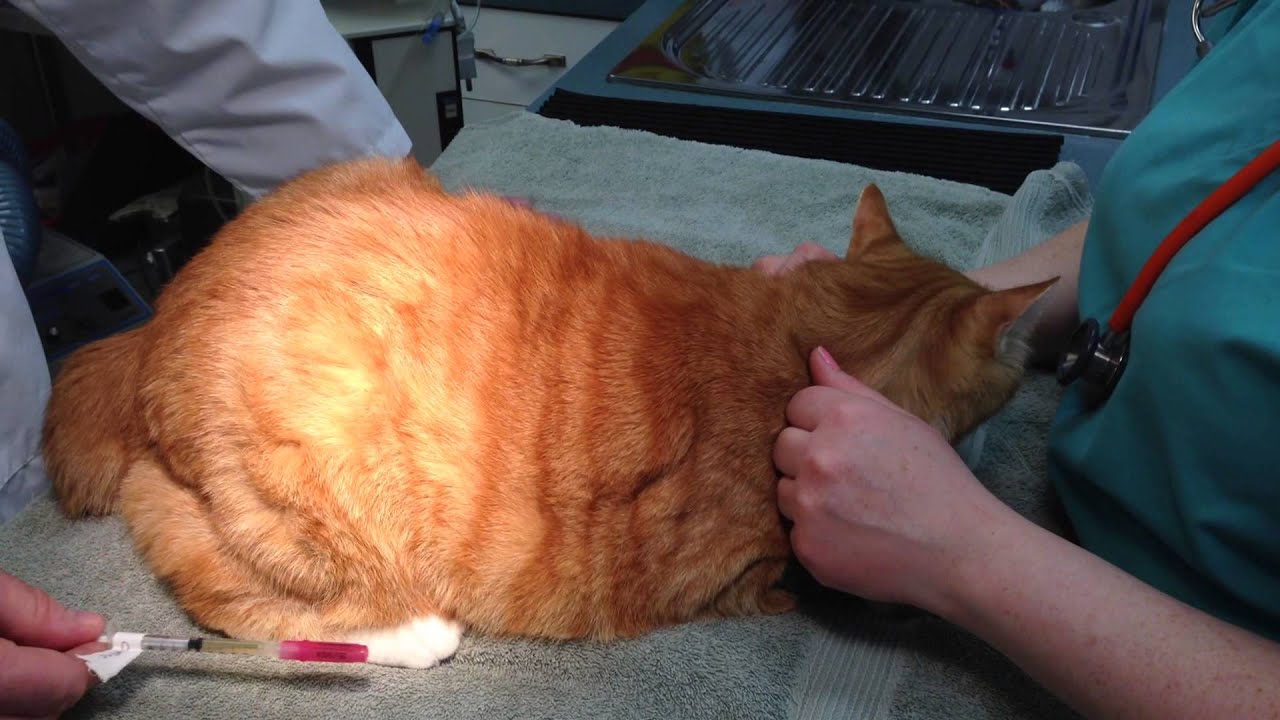 Достаточно, чтобы игла проникла под кожу на 0,5–1 см (инсулиновую можно ввести полностью). Этого хватит, чтобы лекарство попало по назначению.
Достаточно, чтобы игла проникла под кожу на 0,5–1 см (инсулиновую можно ввести полностью). Этого хватит, чтобы лекарство попало по назначению.
В заключение хочется напомнить, что самостоятельное назначение препаратов животному недопустимо. Все подкожные уколы ставятся только после консультации с ветеринаром и по его рекомендации.
Как ставить и правильно сделать кошке укол внутримышечно
Часто лечение кошки сопровождается стрессом как для самого питомца, так и для хозяина. Приходится каждый день ездить в клинику или вызывать врача, что тоже не улучшает обстановку. Если хозяин знает, как правильно ставить укол, то нет необходимости посещать ветеринарную лечебницу. Однако перед этим кошку необходимо обследовать, чтобы знать точный диагноз, и приобрести именно такую инъекцию, которую выпишет ветеринарный врач. Только после этого можно приступать к лечению своего питомца.
Почему необходима внутримышечная инъекция
Мышечная ткань богата на кровеносные сосуды. Введенные в нее лекарственные препараты очень быстро и хорошо всасываются. Кроме того, есть такие лекарственные средства, введение которых подкожно вызывает сильную болезненность или же очень плохо рассасываются из подкожной клетчатки, что приводит к образованию инфильтратов. Если назначены такие препараты, а также когда требуется получить быстрый результат от введенного лекарства, подкожную инъекцию заменяют на внутримышечную.
Введенные в нее лекарственные препараты очень быстро и хорошо всасываются. Кроме того, есть такие лекарственные средства, введение которых подкожно вызывает сильную болезненность или же очень плохо рассасываются из подкожной клетчатки, что приводит к образованию инфильтратов. Если назначены такие препараты, а также когда требуется получить быстрый результат от введенного лекарства, подкожную инъекцию заменяют на внутримышечную.
Также при введении лекарства внутримышечно в мышце образуется что-то наподобие депо, из которого лекарственный препарат медленно поступает в кровеносное русло. Благодаря этому в организме лекарство в нужной концентрации находится довольно долго, что очень важно для антибиотиков.
Техника безопасности
Прежде чем сделать кошке укол, необходимо ознакомиться с техникой безопасности.
Первым делом следует ознакомиться с инструкцией: срок годности препарата, условия хранения, побочные эффекты.
Если врач прописал несколько препаратов, необходимо записать на листок такие сведения:
- точная дозировка лекарственных средств;
- продолжительность курса приема;
- время, когда лучше всего делать укол.

Такой листок нужно повесить на холодильник. Не стоит надеяться на свою память, потому что если перепутать дозировку, питомец может серьезно пострадать.
Необходимо подготовить тарелку, куда нужно будет класть шприцы и ампулы. Перед каждым использованием емкость нужно обдавать кипятком.
Перед тем как использовать шприц, проверяют целостность упаковки. Затем со стороны поршня вскрывают блистер, надевают на поршень иглу, не снимая с нее колпачок.
Перед введением инъекции шприц следует поднять иглой вверх и пальцем постучать по цилиндру. При помощи поршня необходимо выпустить всплывшие пузырьки воздуха.
Укол кошке внутримышечно следует ставить таким образом: игла вводится резко и фиксируется в одном положении. Даже незначительные колебания иглы внутри тканей могут привести к повреждениям, сопровождающиеся болью.
Не следует хранить открытые ампулы.
Шприцем можно пользоваться только один раз.
Общие правила инъекций для кошек
Самое важное – это соблюдение чистоты. Руки необходимо вымыть, а инструменты и место для укола следует обеззаразить. Важно не допустить занесения инфекции с поверхности кожи питомца.
Руки необходимо вымыть, а инструменты и место для укола следует обеззаразить. Важно не допустить занесения инфекции с поверхности кожи питомца.
Если кошка слишком пушистая, необходимо будет выбрить шерсть в том месте, куда будет делаться укол. Это сделает процесс гораздо проще и гигиеничнее. Лучше заниматься с шерстью заранее, чтобы не так сильно волновать питомца.
Для внутримышечных уколов в основном используют инсулиновые шприцы. Но их применяют только тогда, когда объем вводимого препарата будет не более 1 мл, потому что именно столько вмещает инсулиновый шприц. У него оптимальный для кошек диаметр иглы. Такие шприцы используются для большинства препаратов. Если же необходимо ввести густой масляный лекарственный раствор, то лучше всего приобрести шприцы на 2–3 мм, потому что он только забьет тонкую иголку инсулинового шприца.
Если лекарственное средство хранится в холодильнике, то перед уколом ампулу необходимо согреть в руках или теплой воде. При этом вода не должна быть выше +38 градусов.
Следует заранее все приготовить:
- ватку;
- спирт;
- шприцы;
- ампулу с лекарством;
- одеяло, в которое, возможно, придется завернуть кошку.
Необходимо взять в помощники кого-либо из друзей или родственников. Важно, чтобы кошка хорошо знала этого человека. Если же помочь некому, то кошку придется запеленать.
Как сделать кошке укол внутримышечно
- Необходимо сначала успокоить своего питомца. Кошачьи мышцы достаточно мелкие, длинные и в то же время довольно сильные, поэтому инъекцию им делать гораздо труднее, чем людям.
- Перед уколом часто пеленают животное, оставляя открытыми только попу и задние лапы. В таком виде кошку кладут боком на упругую и ровную поверхность, например, диван или стол. От помощника требуется удерживать животное на месте.
- Самая удобная мышца для укола у кошек находится на бедре. Однако здесь есть кость и крупные сосуды. Чтобы случайно не попасть в них, необходимо обхватить мышцу с двух сторон для определения ее границ.
 Лучше всего, если мышца будет не сильно напряжена, в этом случае она немного подвижна и сможет отодвинуться от кости. И к тому же сильно сжатую мышцу очень трудно проколоть иглой.
Лучше всего, если мышца будет не сильно напряжена, в этом случае она немного подвижна и сможет отодвинуться от кости. И к тому же сильно сжатую мышцу очень трудно проколоть иглой. - Кошку следует расслабить, похлопав ее по спине и попе. Затем необходимо смочить вату в спирте и протереть участок, подготовленный для укола.
- Колоть необходимо резким уверенным движением в самый объемный участок мышцы. Игла должна войти на глубину в 1,5–2 см. Если в это время пошла кровь, необходимо сразу вытащить иглу и зажать место укола ватным тампоном. Это означает, что игла попала в сосуд и инъекцию нужно сделать немного в стороне.
- Медленно и равномерно вводят лекарство. Как бы животное ни сопротивлялось, инъекцию все равно необходимо вводить медленно, потому что если делать все быстро, большая часть препарата может вытечь, а на месте укола образуется болезненный желвак.
- После введения лекарства кожу вокруг иглы прижимают ватным тампоном со спиртом и быстрым движением вынимают иглу.
 Место инъекции нужно растереть ваткой или помассировать рукой.
Место инъекции нужно растереть ваткой или помассировать рукой. - В следующий раз нужно колоть в другую лапу.
Заключение
Когда кошка заболевает, любящие хозяева делают все, чтобы облегчить ее состояние. Везут ее в ветеринарную клинику или вызывают на дом врача. Если же хозяин сам умеет делать внутримышечно уколы, то будет лучше, когда он сделает сам укол заболевшей кошке. Это поможет нанести гораздо меньшую травму ее психике.
Как сделать укол вашему любимому коту
Если одна только мысль об уколе вашему коту или кошке наводит на вас страх и ужас, а вид иглы у вашего питомца- приступы паники и неконтролируемых конвульсий, то сумка фиксатор для кошек- это именно то, что облегчит вам эту задачи и позволит сделать укол с минимальными потерями для вас и вашего любимца.
Для начала вы должны понять, что кошка нуждается в вашей помощи и в этом уколе для ее же здоровья. Постарайтесь успокоиться, смирить свой страх и нервозность, и поверьте, не только вам, но и вашему питомцу будет комфортнее и спокойнее. Для начала подготовьте шприц с лекарством, наметьте место для укола, и после того, как всё будет готово и вам не придется ни на что отвлекаться, возьмите вашего любимца к себе на руки.
Для начала подготовьте шприц с лекарством, наметьте место для укола, и после того, как всё будет готово и вам не придется ни на что отвлекаться, возьмите вашего любимца к себе на руки.
Бывают шприцы инсулиновые и туберкулиновые. Вам лучше покупать инсулиновые, так как иглы у них тоньше и короче, а инъекция пройдет безболезненно. В свою очередь инсулиновые шприцы могут быть со съемной иглой и с впаянной (зависит от препарата). Прочитайте внимательно состав лекарства, и если в нем окажется глицерин, то покупайте шприц со съемной иглой, вам будет проще набирать жидкость в шприц. Если препарат окажется не на маслянистой основе, то без раздумий покупайте шприц с неотделимой иглой.
Внимание: лекарство должно быть комнатной температуры или даже чуть теплее, но никак не холодное; перед уколом вам нужно будет выпустить из шприца, с уже набранным лекарством, пузырьки воздуха.
Подкожная инъекция.
Подкожная инъекция делается в кожу- между лопатками. Мышцы здесь разработанные и в постоянной активности, а потому кожа к ним примыкает не плотно. Для начала правильно уложите животное. Вы постараетесь сделать укол, как можно более аккуратно и безболезненно, но для животного это всё равно что-то вроде небольшого стресса и ваш питомец может в ужасе начать вырываться. Не укладывайте кота к себе на колени, как зачастую это делают, вырываясь, он будет отталкиваться именно от ваших ног и может сильно оцарапать их.
Мышцы здесь разработанные и в постоянной активности, а потому кожа к ним примыкает не плотно. Для начала правильно уложите животное. Вы постараетесь сделать укол, как можно более аккуратно и безболезненно, но для животного это всё равно что-то вроде небольшого стресса и ваш питомец может в ужасе начать вырываться. Не укладывайте кота к себе на колени, как зачастую это делают, вырываясь, он будет отталкиваться именно от ваших ног и может сильно оцарапать их.
Желательно делать укол вдвоем, с вашим помощником: поставьте любимца на стол, аккуратно опустите его к поверхности, и приподнимая кожу на холке введите иглу, все ваши действия должны быть спокойными, но в то же время уверенными. После этого выньте иглу быстрым движением, тут как раз медлить не стоит, и зажмите кусочком ваты место укола. Если вы заметили, что шерсть в месте укола влажная, то вы ввели иглу неглубоко, и лекарство просто вылилось из иглы. Запомните: шерсть должна быть сухой! Не стоит делать тут же повторную инъекцию вашему коту, можно переборщить с дозой лекарства (тут не работает принцип: больше- значит лучше). Тем более, кот скорее всего слижет остатки вещества с шерсти и тем или иным образом оно попадет в организм вашего питомца.
Тем более, кот скорее всего слижет остатки вещества с шерсти и тем или иным образом оно попадет в организм вашего питомца.
Внутривенная инъекция.
Дорогие хозяева, этот вид инъекции не стоит делать дома, не мучайте лишний раз животное, не тратьте свои нервы и время, а лучше сразу отвезите к ветеринару. Врач справится с этим куда лучше вас. В единственном случае вам удастся провести эту процедуру самостоятельно- если ветеринар заблаговременно установил катетер в лапу вашему котику. При любом варианте внимательно изучите инструкцию, чтобы правильно и без последствий ввести препарат в вену (струйно – капельно).
После любого укола (подкожного или внутривенного) помассируйте место укола, это позволит лекарству лучше раствориться в тканях. Иногда может возникнуть инфильтр- небольшая шишка. Будьте внимательны: если в скором времени инфильтр не проходит, то отвезите животное к врачу, на первый взгляд безобидная шишечка может преобразоваться в опухоль.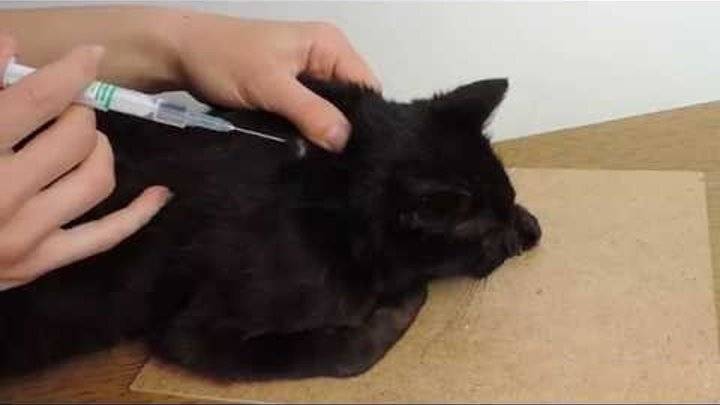
На заметку мастакам уколов своим питомцам: витамины лучше давать животному в виде инъекций, нежели таблеток и порошков. Так витамины лучше усваиваются организмом.
И ваш котик будет премного благодарен вас за сделанный укол.
Уколы собакам и кошкам — внутримышечно, в холку, внутривенно, подкожно. Инъекции животным
Инъекции домашним животным – это процедура безопасная и довольно-таки распространенная. Ввод лекарственных препаратов в организм производится в двух случаях: лечение или профилактика.
Инъекции кошкам и собакам в целях профилактики, выработки иммунитета – это очень важная составляющая ветеринарии. Известно, что при участии в выставках и соревнованиях, паспорт о прививках просто необходим. Уезжающим в дальнее путешествие тоже предварительно нужно оформлять документы о сделанных прививках.
Лечение лекарствами возможно только с разрешения и по рекомендации ветеринарного врача. Любому живому организму самолечение может нанести вред. Некоторые хозяева умеют вводить инъекции самостоятельно. Другие пользуются услугами ветеринарного врача в клинике или вызывают специалиста на дом. Рассмотрим, какие виды уколов существуют в ветеринарии.
Некоторые хозяева умеют вводить инъекции самостоятельно. Другие пользуются услугами ветеринарного врача в клинике или вызывают специалиста на дом. Рассмотрим, какие виды уколов существуют в ветеринарии.
Подкожные инъекции
Как и люди, животные могут принимать лекарства орально. Однако, этот метод наименее эффективный. Распространенный способ лечения – это ввод подкожно. Лекарство в таком случае впитывается намного быстрей. Происходит это за счет расположения под кожей большого количества капилляров. Лекарство быстро впитывается в кровеносную систему, оказывая воздействие на организм.
Данный метод считается самым безболезненным и делается в холку – кожу, расположенную между лопаток. Укол в холку собаке или кошке – процедура не столь сложная. Кожу дезинфицируют спиртом, оттягивают. Далее, зафиксировав питомца на месте, набирают в шприц лекарство, выпускают воздух и вводят иглу в кожу холки на 15 мм под углом около 45 градусов. В завершении, место, где был сделан укол в холку кошке или собаке, обрабатывают спиртом еще раз.
Внутримышечные инъекции
Укол собаке внутримышечно процедура более сложная, но и более эффективная. В мышцах больше кровеносных и лимфатических сосудов, поэтому лекарство впитывается лучше. В данном случае введение лекарства делают в ягодичную мышцу питомца. Обращаться в клинику к ветеринарному врачу всегда надежнее и безопаснее, если у вас мало опыта самостоятельных введений. Опытный специалист знает, каким образом и в каких количествах делать укол кошке внутримышечно, не повредив здоровью. Процедура может иметь такие последствия, как попадание в сосуд, нерв или образование уплотнений.
Внутривенные инъекции
Существуют в ветеринарии уколы, которые вводят напрямую в кровяное русло. Метод этот сложный и опасный, может иметь отрицательные последствия. Данную процедуру можно осуществлять только в клинике у опытного ветеринарного врача.
Как правильно колоть укол кошке
Как правильно сделать укол кошке? Да очень просто, на самом деле это может сделать любой владелец в домашних условиях. При этом вы можете делать уколы своим питомцам как подкожно, так и внутримышечно не отправляя их к ветеринару. Стоит только заранее подготовиться, чтобы все было сделано правильно. Запомните, что инъекция и укол — это одно и то же, точно так же как миллилитр и кубик. Единственное различие, которое характерно для лекарств – это их измерение, а именно не в миллиграммах, а в миллилитрах. В процессе, когда вы делаете укол животному, нет ничего сложного. Небольшая доза жидкости просто поступает под кожу питомца или внутримышечно.
При этом вы можете делать уколы своим питомцам как подкожно, так и внутримышечно не отправляя их к ветеринару. Стоит только заранее подготовиться, чтобы все было сделано правильно. Запомните, что инъекция и укол — это одно и то же, точно так же как миллилитр и кубик. Единственное различие, которое характерно для лекарств – это их измерение, а именно не в миллиграммах, а в миллилитрах. В процессе, когда вы делаете укол животному, нет ничего сложного. Небольшая доза жидкости просто поступает под кожу питомца или внутримышечно.
Естественно, во время самой процедуры могут возникнуть различные проблемы. Как сделать подкожный укол кошке, которая ведет себя агрессивно? На самом деле это практически невозможно, так что лучше подождать пока питомец успокоиться. А если процедуры четко расписаны по графику, то хозяину лично придется успокоить своего кота. Возьмите его за шкирку и прижмите к полу, после чего аккуратно введите иглу под кожу. На самом деле ничего сложного в этом нет и делать уколы просто. Единственная проблема заключается в реакции питомца на все это, поскольку кошки редко дают возможность сделать хозяину то, что им не нравиться. Теперь вы понимаете, как правильно колоть укол кошке, но опять же характеры у домашних животных разные. Если ваше животное чересчур буйное, то попросите помощи у друга или родственника, чтобы поддержали питомца пока вы будете делать укол.
Единственная проблема заключается в реакции питомца на все это, поскольку кошки редко дают возможность сделать хозяину то, что им не нравиться. Теперь вы понимаете, как правильно колоть укол кошке, но опять же характеры у домашних животных разные. Если ваше животное чересчур буйное, то попросите помощи у друга или родственника, чтобы поддержали питомца пока вы будете делать укол.
Как сделать кошке укол внутримышечно? На самом деле точно так же, как и подкожный укол, просто нужно правильно выбрать место на теле животного. Если вы ранее не делали уколов, то лучше обратиться к ветеринару и посмотреть, как он это делает. Возможно, даже стоит попросить специалиста обучить вас. Умея делать уколы своим питомцам, вы сэкономите время на ветеринаров и деньги. Этот полезный навык поможет вам самостоятельно лечить кошку и не обращаться к врачам, а самое главное, что обучение очень легкое, главное — желание.
При этом, очень важным фактором является сам шприц. К его подбору необходимо отнестись очень серьезно, иначе сделать инъекцию не получиться. Если вы собирались делать укол внутримышечно, то лучше всего подойдут шприцы для инсулина. У них очень короткая игла, которая можно вводить даже полностью и при этом маленький диаметр. Соответственно, питомец даже ничего не почувствует, когда вы начнете делать укол. Единственная проблема заключается в том, что такие шприцы могут вместить в себя только 1 миллилитр лекарства, так что, если вам потребуется вколоть больше, придется покупать другой шприц. На самом деле, смотреть необходимо только на диаметр иглы, чтобы животному не было больно. Так что вы легко можете купить другой шприц, просто обращайте внимание на размеры иглы. Не переживайте о том, что вы не умеете делать уколы кошке. Просто сходите к ветеринару и попросите, чтобы вас научили. Это очень полезный навык для владельцев домашних животных, который вам обязательно пригодится.
Если вы собирались делать укол внутримышечно, то лучше всего подойдут шприцы для инсулина. У них очень короткая игла, которая можно вводить даже полностью и при этом маленький диаметр. Соответственно, питомец даже ничего не почувствует, когда вы начнете делать укол. Единственная проблема заключается в том, что такие шприцы могут вместить в себя только 1 миллилитр лекарства, так что, если вам потребуется вколоть больше, придется покупать другой шприц. На самом деле, смотреть необходимо только на диаметр иглы, чтобы животному не было больно. Так что вы легко можете купить другой шприц, просто обращайте внимание на размеры иглы. Не переживайте о том, что вы не умеете делать уколы кошке. Просто сходите к ветеринару и попросите, чтобы вас научили. Это очень полезный навык для владельцев домашних животных, который вам обязательно пригодится.
Читайте еще:
Болезни кошек и их симптомы
Лишний вес у кошки: как быть?
Болезни уха у кошек
Как делать уколы кошке | Блог ветклиники «Беланта»
Содержание статьи
В лечении заболеваний кошек нередко требуется введение инъекций. Оральные препараты и процедуры не всегда могут обеспечить должный результат. Инъекционные средства более эффективны, а иногда просто необходимы при борьбе с серьёзными заболеваниями. Лечебный курс обычно включает несколько уколов. Визиты в ветеринарную клинику для животного зачастую являются стрессом, а хозяевам не всегда легко найти время для регулярных визитов к специалисту. Поэтому имеет смысл освоить правила введения инъекций кошкам, чтобы проводить назначенное лечение самостоятельно.
Оральные препараты и процедуры не всегда могут обеспечить должный результат. Инъекционные средства более эффективны, а иногда просто необходимы при борьбе с серьёзными заболеваниями. Лечебный курс обычно включает несколько уколов. Визиты в ветеринарную клинику для животного зачастую являются стрессом, а хозяевам не всегда легко найти время для регулярных визитов к специалисту. Поэтому имеет смысл освоить правила введения инъекций кошкам, чтобы проводить назначенное лечение самостоятельно.
Общие правила по введению инъекций
Существует несколько общих рекомендаций, которые нужно соблюдать:
- при необходимости делать уколы ежедневно, следует проводить процедуру в одни и те же часы;
- если у животного есть аппетит, перед уколом можно дать лакомство;
- животные чувствуют настроение хозяина, нельзя паниковать, суетиться;
- в процедуре потребуется помощник, который будет держать кошку;
- препарат набирается до привлечения животного, игла закрывается колпачком;
- перед введением инъекции, зона дезинфицируется спиртовым раствором.

Ветеринар, назначающий лечение, подробно объяснит правила введения, что позволит избежать ошибок, обеспечит эффективность лечения, даст совет по выбору шприца для препарата. В большинстве своём, уколы кошкам делаются инструментом, предназначенным для инсулина. Шприцы могут быть с припаянной или съёмной иглой. Если препарат приготовлен на основе масла, глицерина — лучше выбрать шприцы со съёмными иглами. Для жидкого средства подойдёт цельный инструмент, в который можно будет закачать препарат непосредственно из флакона. Если кот крупный, жировые прослойки большие, потребуются шприцы с длинными иглами.
Введение подкожной инъекции
Уколы в подкожные ткани назначаются, если требуется введение быстродействующих средств. В этой зоне находятся жировые слои. Они имеют рыхлую структуру, препарат беспрепятственно распространяется. Благодаря распространённой сети кровеносных сосудов, компоненты лекарства сразу проникают в кровоток, начинают действовать. В подкожные слои могут производиться большие дозы инъекций. Если препарат имеет масляную основу, перед набором в шприц его нужно немного подогреть.
Если препарат имеет масляную основу, перед набором в шприц его нужно немного подогреть.
Оптимальной зоной для подкожных уколов является холка животного. Болевых ощущений во время укола в жировые слои не возникает. Но это не значит, что кошка будет спокойно выносить процедуру. Нужно учитывать возможность резких движений, обязательно зафиксировать питомца, чтобы обеспечить точность введения препарата. Есть препараты, причиняющие боль. Желательно немного прогреть в руке шприц с лекарством, снизить негативные воздействия.
При процедуре нужно постараться успокоить и отвлечь питомца, чтобы исключить сильный стресс. Можно ласково поглаживать животное или поставить перед кошкой миску с любимой пищей. Это поможет расслабить питомца. В это время на холке или между лопатками следует сделать указательным и большим пальцами складку из кожи.
В неё аккуратно вводится препарат. Шприц располагается параллельно позвоночнику, срез иголки должен быть направлен вверх. Важно не проткнуть складку, а ввести иглу точно под кожу на глубину около полутора сантиметров. Убедившись, что она вошла правильно, можно нажимать на поршень. Если дозировка большая, иголку нужно слегка перемещать. После введения препарата, игла осторожно вынимается, кошку при этом нужно ласково поглаживать. Место укола обрабатывается спиртовым раствором. Зону следует немного помассировать, чтобы боль быстрее прошла.
Убедившись, что она вошла правильно, можно нажимать на поршень. Если дозировка большая, иголку нужно слегка перемещать. После введения препарата, игла осторожно вынимается, кошку при этом нужно ласково поглаживать. Место укола обрабатывается спиртовым раствором. Зону следует немного помассировать, чтобы боль быстрее прошла.
Введение внутримышечных препаратов
Небольшие дозировки быстродействующих препаратов нередко предназначаются для внутримышечного введения. В этих тканях расположено много сосудов сети кровотока, лимфотока, что обеспечивает проникновение ингредиентов лекарства в кровь, лимфу. В мышцы обычно вводятся жидкие средства, приготовленные на основе воды. Они хорошо рассасываются, сильных болевых ощущений не вызывают. Но есть в этой категории и препараты болезненные.
Спецификой средств, предназначенных для внутримышечного введения, является длительность воздействия. Мышечные ткани являются своеобразным депо. Лекарство концентрируется в нём, компоненты высвобождаются постепенно. В результате поддерживается необходимая концентрация препарата в организме в течение нескольких часов. Основной группой таких лекарств являются антибиотики.
В результате поддерживается необходимая концентрация препарата в организме в течение нескольких часов. Основной группой таких лекарств являются антибиотики.
Препарат вводится в месте сосредоточения максимального объёма мышечной ткани. Такой зоной является бедро, участок между тазобедренным и коленным суставом. Важно действовать аккуратно, исключить попадание иглы в кость. Перед введением необходимо хорошо прощупать мышечную ткань. Для этого, с одной стороны, нужно упереться большим пальцем в кость, а с другой — указательным, средним пальцами определить место с наибольшим количеством мышечной ткани. Это поможет выявить место соединения кости и мышц, предотвратить попадание в неё иглой.
В ткани бедра есть крупный кровеносный сосуд. Следует исключить попадание в него при введении препарата. В данном случае при введении иглы появляется кровь. Необходимо сразу вынуть её, приложить к месту кровотока ватку, начать введение в другом месте.
К внутримышечным инъекциям кошки относятся по-разному. Есть животные, полностью доверяющие своему хозяину, готовые терпеть уколы. Но в большинстве своём приходится делать инъекции с помощником, который будет держать питомца. Иногда приходится укутывать его в одеяло, полотенце, оставляя свободной только зону укола.
Есть животные, полностью доверяющие своему хозяину, готовые терпеть уколы. Но в большинстве своём приходится делать инъекции с помощником, который будет держать питомца. Иногда приходится укутывать его в одеяло, полотенце, оставляя свободной только зону укола.
Спокойным кошкам делать уколы намного проще. Игла легко входит в расслабленную мышечную ткань, препарат свободно распределяется, не возникает сильных болевых ощущений. Если мышцы напряжены, в них повышается давление, волокна расслаиваются. После уколов в такие ткани могут оставаться шишки. Иногда при сильном напряжении ввести иглу невозможно. Нужно легонько похлопать ладонью по попе кота, это заставит животное расслабить мышцы задних лап.
Последовательность действий при внутримышечном введении лекарственных средств:
- набрать в шприц препарат, выпустить воздух;
- кошку положить на пол или на стол, зафиксировать её;
- нащупать оптимальную зону, обработать её спиртовым раствором;
- ввести иглу, медленно надавливать на поршень для качественного распределения препарата;
- быстро вынуть иглу, обработать зону укола спиртовым раствором.

Котятам, кошкам небольших размеров лекарства вводятся инсулиновыми шприцами. Если питомец крупный, лучше использовать инструменты с длинной иглой — около 5 см. Вводится она в мышечную ткань на глубину 1 см. При необходимости сделать курс уколов, зоны нужно менять, чередовать левое и правое бедро.
После инъекции, зону введения нужно немного помассировать. Если появилась шишка, сильно беспокоиться не нужно. Она постепенно рассосётся. Но при длительном сохранении уплотнения питомца нужно показать ветеринару. В редких случаях такие шишки преобразуются в опухоль. Необходимо исключить такую вероятность.
Дополнительные рекомендации специалистов
Хозяин должен действовать спокойно, чётко, следуя правилам выполнения процедуры. От этого может зависеть качество распределения, эффективность препарата, состояние питомца, уровень стресса кошки. Снизить риск ошибок при применении инъекционных препаратов помогут дополнительные рекомендации специалистов:
Даже спокойная кошка, полностью доверяющая хозяину, может сделать резкие движения во время укола. Нужно обеспечить качественную фиксацию тела в зоне инъекции, не допустить перемещения иглы.
Нужно обеспечить качественную фиксацию тела в зоне инъекции, не допустить перемещения иглы.
Следует приложить максимум усилий, чтобы успокоить питомца перед инъекцией. Укол в расслабленном состоянии причинит меньше болевых ощущений, стресс от процедуры будет не слишком сильным.
После инъекции кошку нужно приласкать, похвалить, покормить любимыми лакомствами. Это позволит в следующей процедуре избежать проблем, избежать формирования панического страха перед уколами.
Особые рекомендации пригодятся владельцам сфинксов. Для них качественная дезинфекция места укола является обязательным условием. Можно для этого использовать спиртовую салфетку. Представители сфинксов отличаются хорошим аппетитом. Эти гурманы готовы ради еды на всё. Нужно использовать эту особенность, сытно покормить питомца после уколов. Это поможет кошке быстро забыть о неприятной процедуре, не бояться её впоследствии.
Интересные темы
Как вакцинировать собаку или кошку
Подкожные вакцины (SQ)
Это наиболее распространенный и безопасный метод введения вакцин. Лучшее место для введения вакцины SQ — это дряблая кожа на плече питомца, потому что это наименее чувствительная область. Избегайте места между лопатками питомца. Поднимите кожу и введите иглу в палатку. Оттяните поршень, чтобы убедиться, что игла не в кровеносном сосуде — если это так, кровь попадет в шприц, и вам придется найти новое место.Если расположение иглы в порядке, осторожно введите вакцину.
Лучшее место для введения вакцины SQ — это дряблая кожа на плече питомца, потому что это наименее чувствительная область. Избегайте места между лопатками питомца. Поднимите кожу и введите иглу в палатку. Оттяните поршень, чтобы убедиться, что игла не в кровеносном сосуде — если это так, кровь попадет в шприц, и вам придется найти новое место.Если расположение иглы в порядке, осторожно введите вакцину.
Внутримышечные вакцины (IM)
Если у вас есть выбор, метод SQ — самый безопасный и простой способ вакцинации, но некоторые вакцины можно вводить только внутримышечно. Вакцины внутримышечно обычно вводятся в толстые мышцы задней поверхности бедер. Осторожно и быстро введите иглу в мышцу под углом 90 градусов. Как и в случае с вакцинами SQ, слегка оттяните поршень, чтобы проверить наличие крови, а затем введите вакцину.Перед тем, как вы попробуете сделать это самостоятельно, вам следует попросить ветеринара показать вам, как вводить внутримышечную вакцину.
Интраназальные вакцины
Большинство интраназальных вакцин смешивают, как инъекционные вакцины, затем на конец шприца помещают капельницу или адаптер для интраназального введения вакцины. Дайте всю дозу своему питомцу. Ваш питомец, вероятно, после этого будет трясти головой или чихать, но не волнуйтесь — вакцина все равно будет эффективна.
Дайте всю дозу своему питомцу. Ваш питомец, вероятно, после этого будет трясти головой или чихать, но не волнуйтесь — вакцина все равно будет эффективна.
После вакцинации очень важно утилизировать иглу и шприц в соответствии с правилами вашего штата или округа.Прочтите «Безопасная утилизация игл и шприцев» для получения дополнительной информации.
Если вам нужна помощь, позвоните нам по телефону 800.786.4751.
— Команда просвещения возрождения
Было ли это полезно? Будем рады вашим отзывам!
Да
Нет
Спасибо за ваш отзыв.
Все еще нужна помощь? Свяжитесь с одним из наших специалистов по уходу за домашними животными.
— или же —
800,786.4751
Материалы, информация и ответы, представленные на этом веб-сайте, не предназначены для замены медицинских советов или услуг вашего личного ветеринара или другого специалиста по уходу за домашними животными. Проконсультируйтесь со своим ветеринаром, чтобы получить ответы на конкретные медицинские вопросы, включая диагностику, лечение, терапию или медицинскую помощь.
Проконсультируйтесь со своим ветеринаром, чтобы получить ответы на конкретные медицинские вопросы, включая диагностику, лечение, терапию или медицинскую помощь.
Седативный эффект внутримышечного введения альфаксалона кошкам
J Vet Med Sci. 2015 Авг; 77 (8): 897–904.
, 1 , 1 , 1 , 1 , 1 , 1 , 1 , 2 , 3 и 1, *
июн TAMURA
1) Отделение клинических наук о мелких животных, Школа ветеринарной медицины, Университет Ракуно Гакуэн, Эбецу, Хоккайдо 069–8501, Япония
Томохито ИШИЗУКА
1) Отделение клинических наук о мелких животных, Школа ветеринарной медицины, Rakuno Gakuen University, Ebetsu, Hokkaido 069–8501, Japan
Sho FUKUI
1) Кафедра клинических наук о мелких животных, Школа ветеринарной медицины, Университет Rakuno Gakuen, Ebetsu, Hokkaido 069–8500002, Япония
hiko
1) Отделение клинических наук о мелких животных, Школа ветеринарной медицины, Университет Ракуно Гакуен, Эбецу, Хоккайдо 069–8501, Япония
Kodai KAWASE
1) 9004 0 Отделение клинических наук о мелких животных, Школа ветеринарной медицины, Университет Ракуно Гакуен, Эбецу, Хоккайдо 069–8501, Япония
Такахару ITAMI
1) Отделение клинических наук о мелких животных, Школа ветеринарной медицины, Университет Ракуно Гакуэн , Ebetsu, Hokkaido 069–8501, Japan
Kenjiro MIYOSHI
1) Кафедра клинических наук о мелких животных, Школа ветеринарной медицины, Университет Ракуно Гакуэн, Эбецу, Хоккайдо 069–8501, Япония
Tadashi 2) Отделение ветеринарных сестринских наук, Школа ветеринарной медицины, Университет Ракуно Гакуен, Эбецу, Хоккайдо 069–8501, Япония
Кирби ПАСЛОСКЕ
3) Jurox Pty Ltd. , Rutherford, NSW 2320, Australia
, Rutherford, NSW 2320, Australia
Kazuto YAMASHITA
1) Кафедра клинических наук о мелких животных, Школа ветеринарной медицины, Университет Ракуно Гакуэн, Эбецу, Хоккайдо 069–8501, Япония
1) Департамент малых Клинические науки о животных, Школа ветеринарной медицины, Университет Ракуно Гакуэн, Эбецу, Хоккайдо 069–8501, Япония
2) Кафедра ветеринарных медсестер, Школа ветеринарной медицины, Университет Ракуно Гакуен, Эбецу, Хоккайдо 069–8501, Япония
3) Jurox Pty Ltd., Rutherford, NSW 2320, Australia
* Для корреспонденции: Yamashita, K., Департамент клинических наук о мелких животных, Школа ветеринарной медицины, Университет Ракуно Гакуэн, Эбецу, Хоккайдо 069–8501, Япония.
Поступило 18.04.2014 г .; Принято 5 марта 2015 г.
Авторские права © Японское общество ветеринарных наук, 2015 г.
Это статья в открытом доступе, распространяемая в соответствии с условиями некоммерческой лицензии Creative Commons Attribution без производных (by-nc-nd).
Эта статья цитируется в других статьях в PMC.
Abstract
Седативные эффекты внутримышечного (IM) альфаксалона в 2-гидроксипропил-бета-циклодекстрине (альфаксалон-HPCD) были оценены на кошках. Кошек лечили альфаксалоном-HPCD пять раз с минимальным 14-дневным интервалом между обработками: внутримышечная инъекция 1,0 мг / кг (IM1), 2,5 мг / кг (IM2,5), 5 мг / кг (IM5). или 10 мг / кг (IM10), или внутривенная инъекция 5 мг / кг (IV5). Седативный эффект оценивался субъективно с использованием комбинированной системы оценки (максимальный балл 16).Кардио-респираторные переменные измерялись неинвазивно. Средний балл седативного действия достигал максимума через 10 минут (9 баллов), 15 минут (14 баллов), 10 минут (16 баллов), от 10 до 20 минут (16 баллов) и от 2 до 5 минут (16 баллов) после IM1, IM2. 5, IM5, IM10 и IV5 соответственно. Лечение IM5 давало более продолжительный седативный эффект по сравнению с лечением IV5. Продолжительность сохранения положения лежа на боку после процедуры IM10 (115 ± 22 мин) была больше, чем после IM2,5 (40 ± 15 минут).
мин), IM5 (76 ± 21 мин) и IV5 (50 ± 5 мин).Кардио-респираторные параметры оставались в пределах клинически приемлемых диапазонов, за исключением каждой кошки, у которой наблюдалась гипотензия (<60 мм рт. Ст.) После лечения IM10 и IV5. Тремор, атаксия и опистотонусная осанка наблюдались в период раннего восстановления после лечения IM2.5, IM5, IM10 и IV5. В заключение, в / м альфаксалон-HPCD вызывает дозозависимый и клинически значимый седативный эффект в дозе от 2,5 до 10 мг / кг у здоровых кошек. Гипотония может возникнуть при более высоких внутримышечных дозах альфаксалона-HPCD.
Ключевые слова: альфаксалон, кошачьи, внутримышечное введение, седация
Химическое сдерживание беспокойных, напуганных или возбужденных кошек является важной клинической процедурой для снижения стресса при обращении и риска травм как для кошек, так и для дрессировщиков [26]. Разумное использование седативных средств или других агентов с анестезирующими или обезболивающими свойствами может быть полезным для химического сдерживания [17]. Однако внутривенное (IV) введение обычно затруднено и / или невозможно у таких животных, не склонных к сотрудничеству.Индукция в камере с помощью ингаляционных анестетиков полезна для защиты обслуживающего персонала от травм, но она имеет связанные недостатки, такие как раздражение дыхательных путей и стресс у пациентов во время фазы индукции [24] и загрязнение отходящими газами [3]. Таким образом, инъекционные агенты, которые можно вводить подкожно или внутримышечно (IM), часто используются для химического сдерживания кошек.
Из-за их доступности и эффективности внутримышечное введение кетамина, опиоидов, агонистов α 2 -адренорецепторов или их комбинаций [6, 17, 27, 28, 31] широко использовалось для химического сдерживания у различных ветеринаров.Однако кетамин был признан наркотиком, контролируемым законом, и его использование в Японии строго ограничено с января 2007 года. Кроме того, следует избегать применения агонистов α 2 -адренорецепторов у кошек с серьезными заболеваниями и / или старением, поскольку они вызывают дозозависимую периферическую вазоконстрикцию и сердечно-сосудистую депрессию за счет снижения сердечного выброса и перфузии крови [6]. Следовательно, клинически важно разработать новые внутримышечные седативные средства, которые минимально снижают сердечно-сосудистую депрессию.
у кошек.
Альфаксалон (3-альфа-гидрокси-5-альфа-прегнан-11,20-дион) представляет собой синтетическую нейроактивную стероидную молекулу, которая модулирует рецептор гамма-аминомасляной кислоты A (GABA A ), вызывающий нейродепрессию и мышечную релаксация [1, 10, 18]. Более низкие концентрации альфаксалона способствуют открытому состоянию канала рецептора GABA A , подобно тому, как это продуцируется бензодиазепином [18]. С другой стороны, альфаксалон в более высоких концентрациях может напрямую активировать канал рецептора GABA A как агонист, аналогично тому, который продуцируется пропофолом или барбитуратами [18].Следовательно, субанестетическая в / м доза альфаксалона может оказывать седативный эффект. Из-за нерастворимости в воде предыдущие продукты альфаксалона (например, Saffan ® ) солюбилизировали 20% полиоксиэтилированным
касторовое масло (Cremophor EL) и содержащийся в ней нейростероид альфадолон. Однако этот продукт был добровольно снят с продажи из-за его побочных эффектов, вызванных высвобождением гистамина, связанного с солюбилизирующим агентом, таких как гиперемия ушной раковины или передней лапы у кошек [8] и анафилактоидная реакция, вызванная гистамином у собак [5] .
Недавно альфаксалон был переработан с другим солюбилизирующим агентом, 2-гидроксипропил-бета-циклодекстрином (HPCD), который не вызывает высвобождения гистамина [4]. Этот состав одобрен в некоторых странах (например, в Австралии) в качестве инъекционного анестетика для внутривенного и внутримышечного введения кошкам. Внутривенное введение альфаксалона-HPCD приводит к плавному наведению анестезии и быстрому выздоровлению с дозозависимым угнетением сердечно-дыхательной системы [23, 29, 33], аналогичным таковому у кошек с пропофолом [29].Основываясь на рекомендациях по дозировке из информационного листа продукта, ожидается, что внутримышечное введение альфаксалона-HPCD (10 мг / кг) вызовет глубокую седацию или легкую анестезию. Grubb et al. [11] сообщил, что администрация IM
Альфаксалон-HPCD (5 мг / кг) для кошек в комбинации с дексмедетомидином (0,01 мг / кг, в / м) и гидроморфоном (0,1 мг / кг, в / м) вызывал легкую общую анестезию с сердечно-сосудистой и респираторной стабильностью. Grubb et al. [11] также упомянул, что внутримышечное введение альфаксалона-HPCD, по-видимому, вызывает больше нежелательных явлений во время выздоровления по сравнению с внутривенным введением.Однако, насколько нам известно, у кошек не сообщалось о седативных и кардиореспираторных эффектах субанестезирующей внутримышечной дозы только альфаксалона-HPCD. Кроме того, влияние способов введения на качество выздоровления не сравнивалось между внутривенным и внутримышечным введением только альфаксалона-HPCD кошкам. Целью настоящего исследования было оценить седативный эффект субанестетических доз внутримышечных (1 мг / кг, 2,5 мг / кг, 5 мг / кг и 10 мг / кг) и внутривенных вводных доз анестетиков (5 мг / кг). альфаксалон-HPCD у кошек.
МАТЕРИАЛЫ И МЕТОДЫ
Экспериментальные животные : Шесть интактных целенаправленных кошек (3 самца и 3 самки), возрастом от 1 до 3 лет [1,8 ± 1,0 (среднее ± стандартное отклонение) года] и весом от 3,0 до 5,4 кг [4,3 ± 0,8 (среднее ± стандартное отклонение) кг], были использованы в настоящем исследовании. Все кошки были оценены как находящиеся в хорошем или отличном состоянии здоровья на основании медицинского осмотра. Пищу не давали по крайней мере на 12 часов перед введением лекарства, но кошкам разрешали свободный доступ к воде перед каждой обработкой.За кошками ухаживали в соответствии с принципами «Руководства по уходу и использованию лабораторных животных», подготовленного Университетом Ракуно Гакуэн. Комитет по уходу за животными и их использованию Университета Ракуно Гакуен одобрил это исследование (утвержденный номер: Vh34B13).
Дизайн исследования : кошки получили 5 обработок с минимальным периодом вымывания 14 дней (от 14 до 685 дней) между обработками. При каждом лечении кошкам вводили одну из следующих 5 доз альфаксалон-HPCD (ALFAXAN, Jurox Pty.Ltd., Резерфорд, Новый Южный Уэльс, Австралия): внутримышечная доза 1 мг / кг (IM1), 2,5 мг / кг (IM2,5), 5 мг / кг (IM5), 10 мг / кг (IM10) или внутривенно. доза 5 мг / кг (IV5). Общие объемы инъекции альфаксалон-HPCD составляли 0,45 ± 0,08, 1,0 ± 0,2, 2,1 ± 0,4, 4,5 ± 0,8 и 1,9 ± 0,4 м л для обработок IM1, IM2,5, IM5, IM10 и IV5 соответственно. Дозы внутримышечно вводили в спинную поясничную мышцу кошек с использованием иглы 23 размера, 1 дюйм (игла для инъекций TOP, TOP Co., Ltd., Токио, Япония). Внутривенная доза вводилась в течение примерно 60 секунд через катетер 22 размера (Supercath, Medikit Co., Ltd., Токио, Япония) ранее помещали в головную вену каждой кошки. Кошкам разрешили дышать комнатным воздухом
спонтанно на протяжении всего эксперимента. Седативные эффекты и кардиореспираторную функцию оценивали у кошек до (исходный уровень) и через 2, 5, 10, 15, 20, 30, 45, 60, 90, 120, 150 и 180 минут после начала введения лекарства.
Оценка седативных эффектов : Седативные эффекты альфаксалона-HPCD были субъективно оценены с использованием комбинированной системы оценки, модифицированной по шкале седативного действия, ранее использовавшейся у собак [32].Наблюдатель (J.T.) не был слепым, но отвечал за оценку с использованием этой системы баллов на протяжении всего настоящего исследования. Система оценок состояла из 5 категорий: спонтанная поза, положение на боку, реакция на шум, расслабление челюсти и общее положение. Эти категории были оценены в баллах от 0 до 2 за расслабление челюсти, от 0 до 3 за положение бока и общее положение или от 0 до 4 за спонтанную позу и реакцию на шум на основе реакции, выраженной кошками (). Оценка седативного эффекта рассчитывалась как сумма баллов по 5 категориям (максимум 16).Кроме того, регистрировали время до наступления положения лежа на боку, первое появление самопроизвольного движения, подъема головы и самостоятельного стояния после начала приема препарата, а также продолжительность отсутствия спонтанного движения и сохранения положения лежа на боку.
Таблица 1.
Комплексная система баллов для оценки седативных эффектов у кошек
| Оценка | ||
|---|---|---|
| Самопроизвольная осанка | Стоя | 1 |
| Лежит, но может подняться | 2 | |
| Лежит с трудом при подъеме | 3 | |
| Невозможно подняться | 4 | |
| 9002 902 | ||
| Умеренное сопротивление | 1 | |
| Незначительное сопротивление | 2 | |
| Отсутствие сопротивления | 3 | |
| Реакция на шум | 902 | 1 |
| Слышит и дергается ухом | 2 | |
| С трудом воспринимает | 3 | |
| Нет ответа | 4 | |
| Слабая челюсть | Плохо | 0 | 2 |
| Общее отношение | Возбудимость | 0 |
| Бодрствование и нормальное состояние | 1 | |
| Спокойствие | 2 | 0–16 |
Измерения сердечно-респираторных ценностей : Электрокардиография (ЭКГ) отведения II, частота сердечных сокращений (ЧСС; уд / мин), ректальную температуру (RT; ° C), среднее артериальное кровяное давление (MABP; мм рт. ст.) и чрескожное насыщение гемоглобина кислородом (SpO 2 ;%) регистрировали до и после введения препарата, пока не были собраны надежные данные. .ЭКГ, ЧСС и SpO 2 регистрировались системой мониторинга пациента (DS-7210, Fukuda Denshi Co., Ltd., Токио, Япония). ЧСС также подсчитывалась при аускультации грудной клетки. Частоту дыхания (ЧД; вдохов / мин) подсчитывали, наблюдая за движениями грудной клетки. RT измеряли с помощью цифрового термометра (Thermo flex для животных, Astec Co., Ltd., Цукуба, Япония). MABP косвенно измеряли осциллометрическим методом (Pet MAP, Ramsey Medical, Inc., Хадсон, Огайо, США) с использованием манжеты для измерения кровяного давления, приблизительно 40% окружности участка измерения по ширине, размещенной вокруг подстриженного основания хвоста каждой кошки.Артериальное давление было
измеряли трижды при каждой оценке, и среднее значение этих измерений определяли как артериальное кровяное давление.
Статистический анализ : Оценка седативного эффекта была представлена как медиана ± квартильное отклонение и проанализирована с помощью теста Краскела-Уоллиса для оценки изменений во времени для каждого лечения. Различия в показателях седативного эффекта при лечении сравнивали с помощью теста Краскела-Уоллиса с тестом Стила-Двасса для апостериорных сравнений.Время, связанное с седативными эффектами и кардиореспираторными переменными, было указано как среднее ± стандартное отклонение. Время, связанное с седативными эффектами, сравнивали с помощью однофакторного (лечебного) факторного дисперсионного анализа ANOVA с тестом Бонферрони для апостериорных сравнений между обработками. Кардио-респираторные переменные анализировали с использованием однофакторного (временного) факторного дисперсионного анализа с тестом Даннета для апостериорных сравнений для каждого лечения. Наблюдения и / или предполагаемые побочные эффекты, связанные с введением лекарств, сравнивали между видами лечения с использованием теста хи-квадрат.Уровень значимости был установлен на уровне P <0,05.
РЕЗУЛЬТАТЫ
Время, необходимое для внутримышечной инъекции, составляло 5 ± 5, 11 ± 9, 8 ± 5 и 35 ± 18 секунд при лечении IM1, IM2.5, IM5 и IM10, соответственно. При лечении IM10 время, необходимое для внутримышечной инъекции, было больше по сравнению с обработками IM1, IM2,5 и IM5 ( P <0,001, P = 0,006 и P = 0,002, соответственно). Вокализация во время внутримышечного введения наблюдалась у 3 кошек (50%), 2 кошек (33%), 4 кошек (67%) и 4 кошек (67%), получавших IM1, IM2.5, IM5 и IM10 соответственно. С другой стороны, ни одна кошка, получавшая лечение IV5, не показала дискомфорта (вокализация, попытки укусить место инъекции или агрессивно возбужденное поведение) во время введения. Не было значительной разницы в частоте вокализации во время внутримышечного введения между курсами лечения ( P = 0,605). Кошки не испытывали дискомфорта (чрезмерный уход за местом инъекции или избегание прикосновения к месту инъекции), и
отек, покраснение и / или другие воспалительные изменения вокруг места внутримышечной инъекции после эксперимента в каждом случае.
Седативный эффект : Время, связанное с седативным эффектом каждого лечения, показано в. Кошки перестали двигаться после того, как они лежали, за исключением одной кошки после процедур IM1 и IM2.5. Лечение IV5 вызывало у всех кошек боковое положение лежа во время инъекции. Все кошки после лечения IM2.5, IM5 и IM10 показали боковое положение лежа в течение 7 минут после начала инъекции. С другой стороны, лечение IM1 обеспечило боковое положение лежа только у 3 кошек (50%), и, следовательно, было невозможно провести статистическое сравнение с использованием этой группы лечения.Таким образом, время, связанное с седативным действием, сравнивалось только статистически среди обработок IM2,5, IM5, IM10 и IV5. Время подъема головы и самостоятельного стояния, а также продолжительность поддержания бокового положения лежа были значительно больше в IM5 ( P = 0,004, P = 0,014 и P = 0,009, соответственно) и IM10 ( P < 0,001, P <0,001 и P <0,001 соответственно), по сравнению с лечением IM2.5.Время до первого появления спонтанных движений и продолжительность отсутствия спонтанных движений были заметно дольше при лечении IM10 по сравнению с IM2,5 ( P <0,001 и P <0,001) и IM5 ( P < 0,001 и P = 0,005). Время подъема головы и вставания без посторонней помощи было значительно больше в IM5, чем в IV5 ( P = 0,033 и P = 0,011). Все наблюдения были завершены через 45 минут после обработки IM1, через 90 минут после IM2.5 и IV5 и через 120 минут после обработки IM5, потому что кошки полностью выздоровели и могли нормально ходить.
Таблица 2.
Время, связанное с седативным действием после начала внутримышечного (IM) или внутривенного (IV) введения альфаксалона-HPCD кошкам
| Введение альфаксалона | |||||
|---|---|---|---|---|---|
| 1 мг IM | 2,5 мг / кг IM | 5 мг / кг IM | 10 мг / кг IM | 5 мг / кг внутривенно | |
| Время до наступления бокового лежачего положения (с) | 451 ± 129 * | 213 ± 143 г) | 152 ± 85 | 128 ± 22 | 27 ± 14 а) |
| Время до первого появления самопроизвольного движения (мин) | 15 ± 10 * | 27 ± 7 c) | 42 ± 12 c) | 74 ± 12 a, b) | 29 ± 12 c) |
| Время до подъема головы (мин) | 22 ± 10 * | 40 ± 15 б, в) | 75 ± 18 а, г) | 100 ± 18 а, г) | 48 ± 6 б, в) |
| Время до стояния без посторонней помощи (мин) | 30 ± 10 * | 60 ± 10 б, в) | 95 ± 24 а, г) | 121 ± 22 а, г) | 59 ± 6 б, в) |
| Продолжительность отсутствия самопроизвольного движения (мин) | 10 ± 11 * | 21 ± 8 в) | 35 ± 16 в) | 72 ± 12 а, б) | 29 ± 12 в) |
| Продолжительность поддержания бокового положения лежа (мин) | 16 ± 12 * | 40 ± 15 б, в) | 76 ± 21 а, в) | 115 ± 22 а, б , d) | 50 ± 5 c) |
Оценка седативного эффекта для каждого лечения представлена в.Каждое лечение давало более высокий балл седативного действия по сравнению с каждым исходным значением ( P <0,001). Максимальный седативный эффект 16 наблюдался у 2 кошек (33%) после лечения IM2.5 и у всех кошек (100%) после лечения IM5, IM10 и IV5. Средняя оценка седативного эффекта достигла максимума через 10 минут после обработки IM1, 15 минут после обработки IM2.5, 10 минут после обработки IM5, 10-20 минут после обработки IM10 и через 2-5 минут после обработки IV5. Показатели седативного эффекта у кошек, которым вводили IM5 и IM10, были значительно выше по сравнению с IM1 ( P <0.001 и P <0,001) и IM2,5 ( P = 0,029 и P <0,001). Не было существенной разницы в оценке седативного эффекта между обработками IM5 и IV5 ( P = 0,984).
Средний балл седативного эффекта (± квартильное отклонение) у 6 кошек до и после начала внутримышечного (IM) или внутривенного (IV) введения альфаксалона-HPCD. Основываясь на реактивности, выраженной кошками, категории комплексной системы оценки были оценены по шкале от 0 до 2 для расслабления челюсти, от 0 до 3 для положения на боку и общего положения или от 0 до 4 для спонтанной позы и реакции на шум ( видеть ).Оценка седативного эффекта рассчитывалась как сумма баллов по этим 5 категориям. а: Значительное отличие от 1 мг / кг в / м ( P <0,05). b: Значительное отличие от 2,5 мг / кг в / м ( P <0,05). c: Значительное отличие от 5 мг / кг в / м ( P <0,05). d: Значительное отличие от 10 мг / кг в / м ( P <0,05). e: Значимое отличие от 5 мг / кг внутривенно ( P <0,05).
В период восстановления атаксия наблюдалась у всех кошек (100%), которым вводили IM2.5, IM5, IM10 и IV5. Преходящий мышечный тремор наблюдался у 2 кошек (33%), 4 кошек (67%), 6 кошек (100%), 6 кошек (100%) и 5 кошек (83%), которым вводили IM1, IM2,5, IM5, IM10 и IV5 соответственно. Опистотонусоподобная поза также наблюдалась у одной кошки (17%), 4 кошек (67%), 3 кошек (50%) и 3 кошек (50%), которым вводили препараты IM2.5, IM5, IM10 и IV5 соответственно ( ). Кроме того, шлепки передними конечностями наблюдались у 4 кошек (67%) и одной кошки (17%), которым вводили IM10 и IV5, соответственно, а бег наблюдался у одной кошки (17%), каждой из которых вводили IM2.5, IM5 и IV5. Кроме того, одну кошку (17%) вырвало в период восстановления после лечения IM10.
Поза, напоминающая опистотонус, наблюдается у кошек в период выздоровления. В период восстановления опистотонусоподобная поза наблюдалась у одной кошки (17%), получавшей 2,5 мг / кг внутримышечно (IM) альфаксалона, 4 кошки (67%) получали 5 мг / кг альфаксалона в / м, 3 кошки (50%) ) получали 10 мг / кг альфаксалона внутримышечно, и 3 кошки (50%) получали 5 мг / кг альфаксалона внутривенно (IV). Кошка показала опистотонусоподобную позу от 60 до 90 мин после обработки IM5 (а).Другая кошка показала опистотонусоподобную осанку в период от 90 до 120 минут после лечения IM10 (b).
Изменения кардиореспираторных ценностей : Кардио-респираторные переменные суммированы в. RT значительно снизился по сравнению с исходным уровнем через 20 минут, 30 минут, 45 минут и 15 минут после обработки M2,5, IM5, IM10 и IV5 соответственно. Легкая гипотермия была обнаружена у 4 кошек (от 34,9 до 35,9 ° C) через 90–150 минут после обработки IM10. Наблюдалось временное увеличение ЧСС от 2 до 5 минут после обработки IM10.Преходящее увеличение ЧСС в период восстановления также было обнаружено при лечении IM5, IM10 и IV5. MABP снизились по сравнению с исходным уровнем во всех группах лечения. В частности, клинически значимая гипотензия (MABP <60 мм рт. Ст.) Наблюдалась у каждой кошки через 10–30 мин после лечения IM10 (от 50 до 57 мм рт. Ст.) И через 2–20 мин после лечения IV5 (от 55 до 58 мм рт. Ст.). Спонтанное дыхание сохранялось у всех кошек, но RR значительно снизился по сравнению с исходным уровнем после лечения IM2,5, IM5, IM10 и IV5.Лечение IV5 вызывало преходящую гипоксемию у 2 кошек (SpO 2 87% и 88%) вскоре после
инъекция.
Таблица 3.
Изменения кардиореспираторных показателей до и после начала внутримышечного (IM) или внутривенного (IV) введения альфаксалона-HPCD
| Минуты после начала введения альфаксалона | |||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| Исходный уровень | 2 | 5 | 10 | 15 | 20 | 30 | 45 | 60 | 90 | 120 | 150 | 180 | |||||||||||||
| 20 RT ( | IM1 | 38.1 ± 0,4 | 38,4 ± 0,4 | 38,1 ± 0,2 | 38,2 ± 0,3 | 38,0 ± 0,3 | 38,0 ± 0,3 | 37,8 ± 0,4 | 37,7 ± 0,6 | ND | ND | ND | ND | ND | |||||||||||
| IM2,5 | 38,4 ± 0,3 | 38,5 ± 0,3 | 38,5 ± 0,2 | 38,3 ± 0,2 | 38,0 ± 0,2 | 37,9 ± 0,2 * | 37,5 902 * 9020 ± 0,2 * | 37.7 ± 0,4 * | 37,8 ± 0,3 * | ND | ND | ND | |||||||||||||
| IM5 | 38,3 ± 0,2 | 38,8 ± 0,4 * | 38,7 ± 0,4 | 38,5 ± 0,3 | 38,1 ± 0,3 | 37,7 ± 0,2 * | 37,2 ± 0,2 * | 37,0 ± 0,2 * | 37,3 ± 0,5 * | 38,2 ± 0,4 | ND | ND | |||||||||||||
| IM10 9020,3 | 38,5 ± 0.4 | 38,4 ± 0,5 | 38,3 ± 0,5 | 38,1 ± 0,5 * | 37,9 ± 0,5 | 37,6 ± 0,4 | 37,1 ± 0,4 * | 36,6 ± 0,4 * | 35,7 ± 0,7 * | 36,3 ± 1,0 * | 36,9 ± 1,0 * | 36,9 | |||||||||||||
| IV5 | 38,5 ± 0,5 | 38,3 ± 0,5 | 38,1 ± 0,4 | 37,8 ± 0,4 | 37,7 ± 0,4 * | 37,4 ± 0,412 * ± 0,4 * | 36,8 ± 0,4 * | 37.2 ± 0,8 * | 37,7 ± 0,4 * | ND | ND | ND | |||||||||||||
| HR (уд / мин) | IM1 | 17112 ± 29 | 178 ± 31 | 177 ± 30 | 176 ± 29 | 179 ± 47 | 177 ± 38 | ND | ND | ND | ND | ND | 172 ± 21 | 178 ± 29 | 179 ± 42 | 161 ± 31 | 157 ± 30 | 155 ± 35 | 167 ± 43 | 207 ± 44 | 211 ± 36 | Н.D. | ND | ND | |
| IM5 | 169 ± 11 | 191 ± 25 | 188 ± 24 | 185 ± 15 | 173 ± 19 | 172 ± 14 | 9 171 ± 29 | 210 ± 34 * | 203 ± 38 | 179 ± 25 | ND | ND | |||||||||||||
| IM10 | 161 ± 9 | 200 ± 17 * | 194 902 * 17520 ± 5 | 168 ± 6 | 161 ± 7 | 152 ± 5 | 142 ± 8 | 142 ± 16 | 192 ± 36 | 203 ± 49 * | 188 ± 32 | 192 | 160 ± 13 | 180 ± 12 | 167 ± 11 | 148 ± 13 | 137 ± 11 | 143 ± 24 | 152 ± 43 | 189 ± 32 | 216 ± 33 * | 185 ± 12 | Н.D. | ND | ND |
| ЧД (вдохов / мин) | IM1 | 48 ± 21 | 80 ± 24 | 44 ± 14 | 33 ± 13 27 | 38 ± 24 | 47 ± 19 | 78 ± 59 | ND | ND | ND | ND | ND | ||||||||||||
| IM2,5 | 64 ± 312 | 28 ± 7 * | 28 ± 11 * | 27 ± 15 * | 22 ± 4 * | 27 ± 8 * | 31 ± 9 * | 46 ± 16 | Н.D. | ND | ND | ||||||||||||||
| IM5 | 57 ± 14 | 46 ± 7 | 35 ± 11 * | 26 ± 8 * | 24 ± 5 * | 21 ± 5 * | 19 ± 4 * | 19 ± 5 * | 25 ± 7 * | 33 ± 8 * | 38 ± 13 * | ND | ND | ||||||||||||
| IM10 | 55 ± 14 | 5612 ± 27 | 21 ± 9 * | 18 ± 6 * | 17 ± 5 * | 16 ± 4 * | 14 ± 5 * | 19 ± 14 * | 30 ± 25 * | 29 ± 9 * | 30 ± 8 * | 32 | |||||||||||||
| IV5 | 46 ± 11 | 17 ± 2 * | 21 ± 2 * | 19 ± 3 * | 19 ± 3 * | 17 ± 3 * | 21 ± 9 * | 22 ± 8 * | 33 ± 12 * | 40 ± 9 | Н.D. | N.D. | N.D. | ||||||||||||
ОБСУЖДЕНИЕ
В настоящем исследовании внутримышечное введение альфаксалон-HPCD вызывало дозозависимую седацию и иммобилизацию с умеренным угнетением сердечно-сосудистой системы у здоровых кошек. В / м альфаксалон-HPCD в дозе 10 мг / кг вызывал аналогичную степень, но более продолжительную седацию и иммобилизацию, по сравнению с IM альфаксалон-HPCD в дозе 5 мг / кг. В / м альфаксалон-HPCD в дозе 5 мг / кг вызывал степень седации и иммобилизации, аналогичную IV альфаксалон-HPCD в дозе 5 мг / кг.Продолжительность седативного эффекта, однако, была более продолжительной после в / м введения альфаксалон-HPCD в дозе 5 мг / кг по сравнению с таковой после внутривенного введения альфаксалон-HPCD в дозе 5 мг / кг. Во время выздоровления у кошек, которым вводили в / м или внутривенно альфаксалон-HPCD, наблюдались тремор, атаксия, опистотонусоподобная поза и временное плавание. Одну кошку вырвало во время выздоровления от IM alfaxalone-HPCD в дозе 10 мг / кг.
На основании рекомендаций по дозировке из информационного листа продукта, внутримышечное введение альфаксалона-HPCD (10 мг / кг) вызовет глубокую седацию или легкую анестезию.Таким образом, в настоящем исследовании мы выбрали четыре возрастающих в / м дозы альфаксалона-HPCD до 10 мг / кг. Некоторые кошки издавали звуки во время внутримышечного введения альфаксалона-HPCD, но не было значительной разницы в частоте вокализации при внутримышечном введении. При лечении IV5 ни одна кошка не испытывала дискомфорта во время введения. Альфаксалон-HPCD имеет нейтральный pH и не вызывает боли и раздражения тканей после внутривенного введения [21] или периваскулярной инъекции [14]. Кроме того, Grubb et al. [11] упомянул, что IM alfaxalone-HPCD в дозе 10 мг / кг, по-видимому, вызывает у кошек умеренный или глубокий дискомфорт из-за его чрезмерного объема инъекции (1
м л / кг). Следовательно, мы предполагаем, что дискомфорт, наблюдаемый в исследовании, был эффектом, связанным с объемом, а не свойством самой композиции альфаксалон-HPCD. На самом деле во время и после эксперимента не наблюдалось отека, покраснения или изменений кожи вокруг места инъекции. Европейская федерация ассоциаций фармацевтической промышленности и Европейский центр валидации альтернативных методов предоставляют рекомендации по администрированию томов IM [7].Сообщаемый объем внутримышечного введения, который считается эффективной практикой, составляет 0,25 м л / кг, а максимальный объем дозы составляет 0,5 м л / кг в руководстве [7], хотя описание объема дозы для кошек отсутствует. Согласно этому руководству [7], доза альфаксалона-HPCD внутримышечно, считающаяся надлежащей практикой, составляет 2,5 мг / кг, а максимальная доза составляет 5 мг / кг на основе
концентрация альфаксалона в одобренном продукте (10 мг / м л ). Мы посчитали, что лечение IM10 не было практическим объемом, потому что лечение IM10 (1 м л / кг одобренного продукта альфаксалон-HPCD) вызывало дискомфорт во время инъекции и требовало большей продолжительности внутримышечного введения.Разработка более концентрированного продукта альфаксалон-HPCD желательна для уменьшения дискомфорта, связанного с большими объемами внутримышечных инъекций, и обеспечения практического удобства.
Целью настоящего исследования было изучить седативный эффект IM alfaxalone-HPCD у кошек без применения каких-либо других лекарственных средств. Поэтому мы выбрали экспериментальный план, в котором было наименьшее количество ноцицептивной стимуляции (т. Е. Манипуляций) во время оценки седативного эффекта и кардиореспираторных переменных.По аналогичным причинам мы не проводили интубацию трахеи во время эксперимента. Для оценки седативного или анестезирующего эффекта мы использовали систему составных баллов. Система оценки была изменена по сравнению с существующей системой оценки, используемой для оценки седативного и обезболивающего действия медетомидина у собак [32], которая состояла из 6 категорий (спонтанная поза, положение на боку, реакция на шум, расслабление челюсти, общее отношение и ноцицептивная реакция на защемление межпальцевых подушечек).Эти категории казались подходящими для оценки степени седативного эффекта у кошек, однако также
предполагалось, что ноцицептивная стимуляция будет иметь некоторое влияние на оценку седативного эффекта, производимого альфаксалоном-HPCD из-за его плохих анальгетических свойств [23]. Поэтому мы модифицировали существующую систему оценки [32], удалив категорию ноцицептивного ответа на защемление межпальцевыми подушечками.
В настоящем исследовании внутримышечное введение альфаксалон-HPCD на 2.5, 5 и 10 мг / кг вызывали клинически значимый седативный эффект. В / м альфаксалон-HPCD в дозе 1 мг / кг не обеспечивал надежного седативного эффекта для здоровых кошек. Показатели седативного эффекта после лечения IM5 и IM10 были выше, чем после лечения IM2.5. Кроме того, время до первого появления спонтанного движения и продолжительность отсутствия спонтанного движения были заметно дольше при лечении IM10 по сравнению с обработками IM2.5 и IM5. Muir et al. [23] сообщил, что альфаксалон-HPCD внутривенно вызывает у кошек дозозависимую нечувствительность.Наблюдения в настоящем исследовании показывают, что альфаксалон-HPCD, вводимый внутримышечно, вызывает у кошек дозозависимый седативный эффект. В / м альфаксалон-HPCD в более высоких дозах (5 и 10 мг / кг) вызывал выраженную и длительную седацию и иммобилизацию у кошек. В / м доза альфаксалона-HPCD в 2,5 мг / кг может обеспечить:
успокаивающее действие, достаточное для обеспечения сосудистого доступа у здоровых кошек.
Внутривенное введение альфаксалона-HPCD в дозе 5 мг / кг является рекомендуемой дозой для индукции анестезии у кошек [23, 30]. Whittem et al. [30] сообщил, что все 8 кошек, получавших 5 мг / кг альфаксалона-HPCD внутривенно, подверглись анестезии вскоре после начала инъекции, а время до первого подъема головы и время до самостоятельного стояния составило 45 и 69 минут, соответственно. Эти результаты согласуются с нашими результатами для кошек, которым вводили IV5. В настоящем исследовании лечение IM5 и IM10 давало более медленное начало, но достигало максимального седативного эффекта (оценка 16) у всех кошек, эквивалентного лечению IV5. Возможно, что внутримышечное введение альфаксалона-HPCD в дозе 5 или 10 мг / кг может обеспечить индукцию анестезии, а также надежную седацию у кошек.Дальнейшее обследование, включая изучение степени сложности интубации трахеи, будет
необходимо для определения надлежащих доз для внутримышечного введения анестетика альфаксалона-HPCD у кошек.
Сообщалось, что внутривенное введение альфаксалон-HPCD приводило к безболезненному выздоровлению у собак [2, 22] и кошек [23, 29]. С другой стороны, также сообщалось, что внутривенное введение альфаксалон-HPCD приводило к плохому качеству выздоровления у собак [16] и кошек [20, 33]. Mathis et al. [20] сообщил, что подергивание, гребля, трение лица, опистотонус и тремор во время выздоровления наблюдались у кошек, получавших альфаксалон-HPCD или пропофол внутривенно. Также сообщалось, что внутривенная индукция альфаксалон-HPCD была связана с большим количеством эпизодов гребли и дрожания во время восстановления по сравнению с индукцией пропофолом [20]. Эти результаты могут быть связаны с различиями в клиренсе лекарств и доле занятого рецептора GABA A между альфаксалоном и пропофолом [9].Аномальное поведение, включая атаксию, повышенную двигательную активность, гиперрефлексию, чувствительность к прикосновениям и резкое выздоровление, также может возникать во время выздоровления от кетаминовой анестезии, и эти реакции, вероятно, связаны с угнетением нижнего бугорка и медиального коленчатого ядра, что приводит к неправильному восприятию слухового и зрительного восприятия. стимулы [19]. В настоящем исследовании почти кошки, получавшие внутримышечную терапию в дозе 2,5-10 мг / кг или внутривенную терапию в дозе 5 мг / кг альфаксалона-HPCD самостоятельно, демонстрировали тремор, атаксию и опистотонусоподобную позу в более ранний период выздоровления. , но ни один кот не был взволнован и не вёл себя агрессивно.С другой стороны, меньшая частота атаксии и тремора во время выздоровления наблюдалась после
внутримышечная обработка альфаксалон-HPCD в дозе 1 мг / кг. Кроме того, IM альфаксалон-HPCD в самой высокой дозе (10 мг / кг) ассоциировался с греблей и рвотой. Ранее не сообщалось о рвоте как о побочном эффекте альфаксалон-HPCD. Необходимы дальнейшие исследования, чтобы выяснить, рассматриваются ли предполагаемые побочные эффекты во время выздоровления как прямой побочный эффект альфаксалона-HPCD или нет.
Частота этих эпизодов во время выздоровления в настоящем исследовании была выше, чем в предыдущих исследованиях [20, 33].Mathis et al. [20] сообщил, что подергивание, гребля, трение лица, опистотонус и тремор наблюдались во время восстановления от анестезии у 14,3, 21,3, 4,3, 12,8 и 21,3% из 47 кошек, принадлежащих клиентам, получавших внутривенно альфаксалон-HPCD для индукции анестезии, соответственно [ 20]. В этом исследовании все кошки получали премедикацию ацепромазином (0,05 мг / кг внутримышечно) и бупренорфином (0,01 мг / кг внутримышечно) перед внутривенной индукцией альфаксалон-HPCD [20]. Заки и др. [33] показали, что премедикация (ацепромазин 0.03 мг / кг и буторфанол 0,3 мг / кг, вводимые подкожно) улучшили качество выздоровления после
Внутривенное введение альфаксалон-HPCD. Аналогичным образом сообщалось, что качество восстановления после анестезии альфаксалоном-HPCD было лучше у кошек, получавших премедикацию ацепромазином или медетомидином, по сравнению с таковыми у кошек без премедикации [13]. Эти данные показывают, что премедикация седативными и анальгетическими препаратами улучшит качество восстановления после альфаксалон-HPCD у кошек. Напротив, Grubb et al. [11] сообщил, что премедикация дексмедетомидином (0,01 мг / кг в / м) или дексмедетомидином плюс гидроморфон (0,1 мг / кг в / м) не улучшила качество восстановления после в / м альфаксалон-HPCD (5 мг / кг), и упомянул, что седативный эффект дексмедетомидина мог исчезнуть до периода выздоровления. Необходимы дальнейшие исследования, чтобы определить влияние премедикации на качество восстановления после IM alfaxalone-HPCD у кошек.
Muir et al. [23] сообщил, что внутривенное введение альфаксалона-HPCD вызывает дозозависимое сердечно-респираторное угнетение, а внутривенное введение 5 мг / кг вызывает гипоксию, связанную с гиповентиляцией, в основном вызванную снижением частоты дыхания и временным апноэ у кошек.Эти результаты согласуются с нашими результатами для кошек, получавших лечение IV5. В настоящем исследовании спонтанное дыхание сохранялось, но RR снизился у всех кошек, получавших IM2,5, IM5, IM10 и IV5. Кардио-респираторные изменения были в пределах нормы у всех кошек, получавших лечение IM1, IM2.5 и IM5. В / м альфаксалон-HPCD в наивысшей дозе (10 мг / кг) вызывал клинически значимую гипотензию у одной кошки. Эти данные предполагают, что внутримышечное введение альфаксалона-HPCD вызывает умеренное дозозависимое сердечно-респираторное угнетение, которое не имеет клинического значения до доз 5 мг / кг.Тем не мение,
В настоящем исследовании было ограничение, потому что мы использовали косвенные методы для измерения кардиореспираторных ценностей, чтобы добиться меньшей ноцицептивной стимуляции. У кошек осциллометрический метод может привести к занижению артериального давления по сравнению с прямым измерением артериального давления [12, 25]. Тремор во время фазы восстановления может повлиять на точность измерения артериального давления, измеренного осциллометрическим методом. Кроме того, недостаточное пропускание света и движение животных являются самыми большими ограничениями для измерения SpO 2 [15].Прикладывали датчик SpO 2 к языку при отсутствии самопроизвольных движений и периодически меняли. Дальнейшие сложные кардиореспираторные измерения, включая анализ газов артериальной крови и измерение сердечного выброса или дыхательного объема, потребуются для
подтвердить сердечно-легочную депрессию, вызванную IM alfaxalone-HPCD у кошек.
В заключение, в / м альфаксалон-HPCD в дозах 2,5, 5 и 10 мг / кг вызывал дозозависимую седацию и иммобилизацию у кошек.Мощность дозы 10 мг / кг вызывала аналогичную степень седативного эффекта, но более продолжительную седацию по сравнению с IM альфаксалон-HPCD в дозе 5 мг / кг. Альфаксалон-HPCD в / м вызывал умеренное дозозависимое угнетение сердечно-дыхательной системы в дозах до 5 мг / кг. При дозе 10 мг / кг в / м альфаксалон-HPCD вызывал клиническую гипотензию у одной кошки и был связан с рвотой у другой кошки. Некоторые кошки издавали звуки во время внутримышечного введения альфаксалона-HPCD, однако считалось, что вокализация была связана с введением внутримышечной инъекции, а не с болевой реакцией.В течение раннего периода выздоровления нежелательные эффекты, включая тремор, атаксию и опистотонусоподобную позу, были связаны с внутримышечным введением альфаксалона-HPCD в дозе от 2,5 до 10 мг / кг. Тем не менее, мы не рекомендуем IM alfaxalone-HPCD в дозе 10 мг / кг из-за чрезмерного объема IM (1 м л / кг).
Премедикация седативными и / или анальгетиками должна стать предметом будущих исследований, чтобы уменьшить объем внутримышечной инъекции альфаксалона-HPCD и улучшить качество выздоровления.
ЛИТЕРАТУРА
1.Альбертсон Т. Э., Уолби В. Ф., Джой Р. М. 1992. Модификация ГАМК-опосредованного ингибирования различными инъекционными анестетиками. Анестезиология 77: 488–499. DOI: 10.1097 / 00000542-199209000-00014 [PubMed] [CrossRef] [Google Scholar] 2. Амброс Б., Дюк-Новаковски Т., Паслоске К. С. 2008. Сравнение анестезирующей эффективности и сердечно-легочных эффектов непрерывных инфузий альфаксалон-2-гидроксипропил-бета-циклодекстрина и пропофола у собак. Am. J. Vet. Res. 69: 1391–1398.doi: 10.2460 / ajvr.69.11.1391 [PubMed] [CrossRef] [Google Scholar] 3. Беднарский Р. М.2007. Собаки и кошки. С. 705–716. В : Ветеринарная анестезия и обезболивание поясницы и Джонса, 4-е изд. (Транквилли, У. Дж., Турмон, Дж. К. и Гримм, К. А. ред.), Blackwell Publishing, Ames. [Google Scholar] 4. Брэнсон К. Р. 2007. Инъекционные и альтернативные методы обезболивания. С. 273–300. В : Ветеринарная анестезия и обезболивание поясницы и Джонса, 4-е изд. (Транквилли, У. Дж., Турмон, Дж. К. и Гримм, К.A. eds.), Blackwell Publishing, Ames. [Google Scholar] 5. Чайлд К. Дж., Карри Дж. П., Дис Б., Доддс М. Г., Пирс Д. Р., Твиссел Д. Дж. 1971. Фармакологические свойства нового стероидного анестетика CT1341 у животных. руб. J. Anaesth. 43: 2–13. doi: 10.1093 / bja / 43.1.2-a [PubMed] [CrossRef] [Google Scholar] 6. Каллен Л. К. 1996. Седативный эффект медетомидина у собак и кошек: обзор его фармакологии, антагонизма и дозы. руб. Вет. J. 152: 519–535. DOI: 10.1016 / S0007-1935 (96) 80005-4 [PubMed] [CrossRef] [Google Scholar] 7.Дил К. Х., Халл Р., Мортон Д., Пфистер Р., Рабемампианина Ю., Смит Д., Видаль Дж. М., ван де Форстенбош К., Европейская федерация ассоциации фармацевтической промышленности и Европейский центр валидации альтернативных методов, 2001. Руководство по эффективной практике введения веществ и удаления крови, включая способы и объемы. J. Appl. Toxicol. 21: 15–23. doi: 10.1002 / jat.727 [PubMed] [CrossRef] [Google Scholar] 8. Додман Н. Х. 1980. Осложнения анестезии шафаном у кошек. Вет. Рек. 107: 481–483. doi: 10.1136 / vr.107.21.481 [PubMed] [CrossRef] [Google Scholar] 9. Ферчичи С., Тронси Э., Гийо М., Риалланд П., Тручетти Г., дель Кастильо Дж. Р. 2013. Волнение у собак, выздоравливающих после анестезии альфаксалоном: виновато ли отсутствие препарата в ошибке? Вет. Анаэст. Анальг. 40: 655–656. doi: 10.1111 / vaa.12085 [PubMed] [CrossRef] [Google Scholar] 10. Гудчайлд С. С., Го З., Надесон Р. 2000. Антиноцицептивные свойства нейростероидов I. Спинально-опосредованные антиноцицептивные эффекты водорастворимых аминостероидов. Боль 88: 23–29. DOI: 10.1016 / S0304-3959 (00) 00301-8 [PubMed] [CrossRef] [Google Scholar] 11. Грабб Т. Л., Грин С. А., Перес Т. Э. 2013. Сердечно-сосудистые и респираторные эффекты, а также качество анестезии, производимой альфаксалоном, вводимым внутримышечно кошкам, получавшим седативные препараты дексмедетомидином и гидроморфоном. J. Feline Med. Surg. 15: 858–865. doi: 10.1177 / 1098612X13478265 [PubMed] [CrossRef] [Google Scholar] 12. Хаберман К. Э., Морган Дж. Д., Канг С. В., Браун С. А, 2004.
Оценка допплеровских ультразвуковых и осциллометрических методов непрямого измерения артериального давления у кошек. Стажер . J. Appl. Res. Вет. Med. 2: 279–289. [Google Scholar] 13. Хейт М., Шнелл М., Уилтем Т., Паслоске К., 2004.
Кардиоваскулярная и респираторная безопасность ALFAXAN ®- CD RTU у кошек, предварительно получавших лечение ацепромазином, медетомидином, мидазоламом или буторфанолом. J. Vet. Междунар. Med. 18: 419–420. [Google Scholar] 14. Хейт М., Шнелл М., Уилтем Т., Паслоске К., 2004.
Безопасность и эффективность ALFAXAN ®- CD RTU, вводимого кошкам однократно подкожно в дозе 10 мг / кг. J. Vet. Междунар. Med. 18: 432. [Google Scholar] 15. Якобсон Дж. Д., Миллер М. В., Мэтьюз Н. С., Хартсфилд С. М., Кнауэр К. В. 1992. Оценка точности пульсоксиметрии у собак. Am. J. Vet. Res. 53: 537–540. [PubMed] [Google Scholar] 16. Хименес К. П., Матис А., Мора С. С., Бродбелт Д., Алибхай Х. 2012. Оценка качества восстановления после введения пропофола или альфаксалона для индукции анестезии у собак, анестезированных для магнитно-резонансной томографии. Вет. Анаэст. Анальг. 39: 151–159. doi: 10.1111 / j.1467-2995.2011.00678.x [PubMed] [CrossRef] [Google Scholar] 17. Карась А. З. 1999. Седативный эффект и химическая сдержанность у собак и кошек. Clin. Tech. Small Anim. Практик. 14: 15–26. DOI: 10.1016 / S1096-2867 (99) 80023-1 [PubMed] [CrossRef] [Google Scholar] 18. Ламберт Дж. Дж., Белелли Д., Педен Д. Р., Варди А. В., Питерс Дж. А. 2003. Нейростероидная модуляция рецепторов GABA A . Прог. Neurobiol. 71: 67–80. DOI: 10.1016 / j.pneurobio.2003.09.001 [PubMed] [CrossRef] [Google Scholar] 19. Лин Х. С. 2007. Диссоциативные анестетики. С. 301–353. В : Ветеринарная анестезия и обезболивание поясницы и Джонса, 4-е изд. (Транквилли, У. Дж., Турмон, Дж. К. и Гримм, К. А. ред.), Blackwell Publishing, Ames. [Google Scholar] 20. Матис А., Пинелас Р., Бродбелт Д. К., Алибхай Х. I, 2012. Сравнение качества восстановления после наркоза у кошек, индуцированного пропофолом или альфаксалоном. Вет. Анаэст. Анальг. 39: 282–290.doi: 10.1111 / j.1467-2995.2011.00707.x [PubMed] [CrossRef] [Google Scholar] 21. Мишу Дж. Н., Лис Э. А., Брирли Дж. С. 2012. Сравнение боли при инъекции во время индукции анестезии альфаксалоном и двумя препаратами пропофола у собак. Вет. Анаэст. Анальг. 39: 275–281. doi: 10.1111 / j.1467-2995.2012.00709.x [PubMed] [CrossRef] [Google Scholar] 22. Мьюир В., Лерш П., Визе А., Нельсон Л., Паслоске К., Уиттем Т. 2008. Кардиореспираторные и анестезирующие эффекты клинических и супраклинических доз альфаксалона у собак. Вет. Анаэст. Анальг. 35: 451–462. doi: 10.1111 / j.1467-2995.2008.00406.x [PubMed] [CrossRef] [Google Scholar] 23. Мьюир В., Лерш П., Визе А., Нельсон Л., Паслоске К., Уиттем Т. 2009. Кардиореспираторные и анестезирующие эффекты клинических и супраклинических доз альфаксалона у кошек. Вет. Анаэст. Анальг. 36: 42–54. doi: 10.1111 / j.1467-2995.2008.00428.x [PubMed] [CrossRef] [Google Scholar] 24. Муто Т., Канамару А., Судзуки Х., Цубоне Х., Нисимура Р., Сасаки Н. 2001. Дыхательные рефлексы у спонтанно дышащих анестезированных собак в ответ на назальное введение севофлурана, изофлурана или галотана. Am. J. Vet. Res. 62: 311–319. doi: 10.2460 / ajvr.2001.62.311 [PubMed] [CrossRef] [Google Scholar] 25. Педерсен К. М., Батлер М. А., Эрсбёлл А. К., Педерсен Х. Д., 2002. Оценка осциллометрического монитора артериального давления для использования у анестезированных кошек. J. Am. Вет. Med. Доц. 221: 646–650. doi: 10.2460 / javma.2002.221.646 [PubMed] [CrossRef] [Google Scholar] 26. Родан И., Сундал Э., Карни Х., Ганьон А. С., Хит С., Ландсберг Г., Сексель К., Инь С., Американская ассоциация больниц для животных, 2011.Рекомендации AAFP и ISFM по обращению с кошками. J. Feline Med. Surg. 13: 364–375. doi: 10.1016 / j.jfms.2011.03.012 [PubMed] [CrossRef] [Google Scholar] 27. Селми А. Л., Мендес Г. М., Линс Б. Т., Фигейредо Дж. П., Барбудо-Сельми Г. Р., 2003. Оценка седативных и кардиореспираторных эффектов дексмедетомидина, дексмедетомидин-буторфанола и дексмедетомидин-кетамина у кошек. J. Am. Вет. Med. Доц. 222: 37–41. doi: 10.2460 / javma.2003.222.37 [PubMed] [CrossRef] [Google Scholar] 28.Смит А. А., Познер Л. П., Гольдштейн Р. Э., Ладдерс Дж. У., Эрб Х. Н., Симпсон К. В., Глид Р. Д., 2004. Оценка эффектов премедикации при гастродуоденоскопии у кошек. J. Am. Вет. Med. Доц. 225: 540–544. doi: 10.2460 / javma.2004.225.540 [PubMed] [CrossRef] [Google Scholar] 29. Табоада Ф. М., Мурисон П. Дж. 2010. Введение анестезии альфаксалоном или пропофолом перед поддерживающей терапией изофлураном у кошек. Вет. Рек. 167: 85–89. doi: 10.1136 / vr.b4872 [PubMed] [CrossRef] [Google Scholar] 30.Уиттем Т., Паслоске К.С., Хейт М.С., Ранасинге М.Г., 2008. Фармакокинетика и фармакодинамика альфаксалона у кошек после однократного и многократного внутривенного введения альфаксана в клинических и супраклинических дозах. J. Vet. Pharmacol. Ther. 31: 571–579. DOI: 10.1111 / j.1365-2885.2008.00998.x [PubMed] [CrossRef] [Google Scholar] 31. Визе А. Дж., Мюр В. В. 2007. Анестезирующие и сердечно-легочные эффекты морфина, медетомидина и кетамина внутримышечно, вводимых телеметрическим кошкам. J. Feline Med. Surg. 9: 150–156. DOI: 10.1016 / j.jfms.2006.11.002 [PubMed] [CrossRef] [Google Scholar] 32. Янг Л. Э., Брирли Дж. С., Ричардс Д. Л. С., Бартрам Д. Х., Джонс Р. С. 1990.
Медетмидин как премедикация у собак и его отмена атипамезолом. J. Small Anim. Практик. 31: 554–559. doi: 10.1111 / j.1748-5827.1990.tb00685.x [CrossRef] [Google Scholar] 33. Заки С., Тайсхерст К., Мияки Ю. 2009. Клиническая оценка Alfaxan-CD ® в качестве внутривенного анестетика у молодых кошек. Aust. Вет. J. 87: 82–87. doi: 10.1111 / j.1751-0813.2009.00390.x [PubMed] [CrossRef] [Google Scholar]
Внутримышечная инъекция — обзор
Внутримышечная и внутривенная
Внутримышечные и внутривенные инъекции являются наиболее распространенной техникой, используемой для введения лекарств при рептилий из-за доступа, быстрого поглощения и распространения. Как правило, при опасном для жизни грамотрицательном сепсисе предпочтительнее внутривенное введение. К сожалению, это не всегда возможно из-за ограниченного или трудного доступа.По возможности, когда необходим внутривенный путь введения, следует делать все возможное, чтобы его приобрести.
Обезвоживание и гипотермия не влияют на поглощение лекарств при внутривенном введении, в отличие от внутримышечного и других способов введения. В целом, это редкий пациент-рептилия, который не может ждать от 12 до 24 часов, пока гидратация и термический статус вернутся к норме, перед введением антибиотиков или других химиотерапевтических средств.
Внутримышечные инъекции часто используются, когда они не подходят, особенно для раздражающих соединений или для рептилий с ограниченной мышечной массой.В этих случаях могут быть предпочтительны внутривенные инъекции, поскольку они быстро растворяются. Внутримышечные инъекции следует делать только тогда, когда производитель указывает на этикетке, что это уместно. Некоторые раздражающие соединения, такие как Байтрил (Bayer Corp), рекомендуют однократную внутримышечную инъекцию и дополнительные дозы перорально. К сожалению, сообщения в литературе подтверждают использование многократных внутримышечных инъекций этого соединения, которые могут вызвать некроз мышц, депигментацию кожи и шелушение (рис. 36-17).
По возможности следует избегать внутримышечных инъекций мелким видам рептилий, таким как гекконы и хамелеоны. Множественные внутримышечные инъекции в ограниченную мышечную массу могут вызвать изменение способности рептилии передвигаться или вызвать временный парез. В течение длительного периода лечения это может повлиять на способность рептилии получать пищу и воду, что приведет к дополнительным проблемам.
Как давать кошке инъекционные лекарства
Введение кошке лекарства, вероятно, наименее увлекательный способ следовать указаниям врача, поскольку, скорее всего, это требуется постоянно.Такие заболевания, как диабет или аллергия, часто требуют инъекций, но следование рекомендациям ветеринара поможет вашей кошке быть счастливой и здоровой на долгое время.
Инъекционные препараты можно назначать как для подкожного, так и для внутримышечного введения. Большинство лекарств, которые ветеринары отпускают владельцам дома, предназначены для подкожного введения. Обсудите правильный путь и технику с вашим ветеринаром, прежде чем вводить лекарство в домашних условиях.
Для препаратов, которые можно вводить подкожно, вы можете попробовать следующий метод:
Помните, если вам неудобно принимать инъекционные препараты; обсудите другие альтернативы с вашим ветеринаром. Если у вас возникли трудности, позвоните в офис ветеринара и спросите, можете ли вы зайти и попросить ветеринара или одного из техников продемонстрировать вам методику.
Вот совет, который сработал для некоторых владельцев домашних животных. Если вы не хотите брать с собой питомца, иногда можно попрактиковаться с лекарством и шприцем на кусочке фрута, например, на апельсине или банане.
Кота держат правой рукой, слегка прижимая к себе. Шприц с приготовленным лекарством берут в правую руку, а левой формируют на холке складку кожи. Прокол делают уверенным, но не резким движением, направляя иглу параллельно телу у основания складки и вводя ее на 1-2 см немного под углом. После прокола сразу же введите лекарство. Необходимо следить за тем, чтобы проколоть кожную складку насквозь, тогда лекарство с другой стороны потечет из шприца и все придется начинать заново.Иглу выводят наружу, не выпуская кожную складку. После введения место укола следует слегка помассировать для более равномерного распределения лекарства под кожей. Подкожно разрешено вводить от 30 до 60 мл лекарства, дозировка зависит от веса кошки. Кровотечение и хромота. При небольшом количестве крови, выступившей после прокола кожи, место инъекции промокают ватным диском, смоченным в медицинском спирте. Если кровотечение продолжается, на место укола прикладывают кусок льда или снега, завернутый в мягкую ткань (марлю).Если такой способ остановки крови не помогает, необходимо срочно обратиться к ветеринару. После введения многих препаратов у животного может проявляться хромота. Чаще всего это нормально. Через несколько минут боль проходит, и кошка начинает хорошо наступать на лапу. Если выпускница подволакивает лапу или вообще не наступает на нее, возможно, пробито нервное окончание. В этом случае бедро отрезают новокаином. Обращаться к ветеринару необходимо, если на бедре образовалась горячая на ощупь опухоль или образовалась шишка, если здоровье кошки ухудшилось.Внимательный хозяин должен уметь делать укол, если нет возможности обратиться к специалисту. Ответственность за здоровье питомца лежит на его хозяине.
Животное в доме — это большая ответственность. Но, несмотря на заботу, они иногда болеют и нуждаются в помощи человека. А поскольку услуги ветеринара по каким-либо причинам могут быть недоступны, хозяину придется самостоятельно нанести кошке укол внутримышечно и под холку.
Правильно сделанный укол — гарантия того, что лекарство подействует быстро и не будет осложнений.
Подготовка к процедуре
Инъекции в домашних условиях делаются только по назначению врача, при строгом соблюдении дозировки. Что нужно знать и уметь владельцу кошки:
- Сначала нужно вымыть руки с мылом.
- К стерильной игле нельзя прикасаться руками, даже если они чистые.
- Место прокола нельзя дезинфицировать, но каждую последующую инъекцию нужно делать свежим стерильным шприцем.
- Кожа на месте будущего укола должна быть здоровой, без высыпаний и язв.
- Если доза лекарства не превышает 1 мл и это не масло, можно использовать инсулиновый шприц, в остальных случаях используются обычные шприцы большего объема.
- Лекарство, хранящееся в холодильнике, обязательно следует подогреть до температуры тела кошки.
- Перед уколом рекомендуется проверить срок годности лекарства.
- Запрещается набирать в один шприц несколько препаратов, если это не прописано врачом.
- Лекарство набирается в шприц строго перед уколом, а игла должна быть закрыта специальным колпачком до момента использования.
- Лекарства колоть масло лучше всего доверить специалисту. Важно убедиться, что масло попало в мышцу, а не в кровеносный сосуд. При прокалывании мышцы необходимо подтянуть поршень шприца вверх и при появлении крови сменить место. Если масло при попадании в сосуд разойдется при рождении, возможен летальный исход.
- Перед введением иглы необходимо выпустить попавший в шприц воздух, если внутри все же остались пузырьки с воздухом, вводить все лекарство не следует.
- Движения у укола должны быть также точными. Если животное сопротивляется, его заворачивают в полотенце, оставляя свободными голову и ту часть тела, в которую ему будет вводиться инъекция.
- Не надо кричать на кошку, лучше успокоить и дать лакомство.
Внутримышечная инъекция
Для уколов в мышцу чаще всего используют шприц для инсулина , маленькая игла которого не позволит ввести его слишком глубоко, а диаметр иглы такого шприца меньше, поэтому ткани почти не травмируются.
Этот вариант исключен при введении масляных препаратов.
Внутримышечный укол более болезненный, чем подкожный, поэтому кошка должна быть обязательно хорошо зарегистрирована, чтобы она не могла сбежать во время процедуры. Инструкция по внутримышечному уколу:
- Животное двумя руками прижимает к твердой поверхности.
- Проколоть заднюю часть бедра, обхватив ее изнутри.
- Инъекция производится под углом на глубину 1−1.5 см
Животное выпускается только после извлечения из тела иглы. При лечении курсом вводят по очереди в правое и левое бедро.
Укол в холке
Непосредственно перед уколом питомца нужно успокоить, ласково поговорить с ним, погладить. Действия при уколе в холку следующее:
- Кошку держат правой рукой, слегка прижимая ее к себе.
- Шприц с приготовленным лекарством берут в правую руку, а левой формируют на холке складку кожи.
- Прокол делают уверенным, но не резким движением, направляя иглу параллельно телу у основания складки и вводя ее на 1-2 см немного под углом.
- После прокола сразу же введите лекарство.
- Необходимо следить за тем, чтобы проколоть кожную складку насквозь, тогда лекарство потечет из шприца с другой стороны и все придется начинать заново.
- Иглу выводят наружу, не выпуская кожную складку.
- После введения место укола следует слегка помассировать для более равномерного распределения лекарства под кожей.
Подкожно разрешено вводить от 30 до 60 мл лекарства, дозировка зависит от веса кошки.
Кровотечение и хромота
При небольшом количестве крови, выступившей после прокола кожи, место инъекции промокают ватным диском, смоченным в медицинском спирте. Если кровотечение продолжается, на место укола прикладывают кусок льда или снега, завернутый в мягкую ткань (марлю). Если такой способ остановки крови не помогает, необходимо срочно обратиться к ветеринару.
После введения многих препаратов у животного может проявляться хромота. Чаще всего это нормально. Через несколько минут боль проходит, и кошка начинает хорошо наступать на лапу.
Если выпускница подволакивает лапу или вообще не наступает на нее , возможно, пробито нервное окончание. В этом случае бедро отрезают новокаином. Обращаться к ветеринару необходимо, если на бедре образовалась горячая на ощупь опухоль или образовалась шишка, если здоровье кошки ухудшилось.
Внимательный хозяин должен уметь делать укол, если нет возможности обратиться к специалисту. Ответственность за здоровье питомца лежит на его хозяине.
VASG Введение инъекций жестким кошкам
Обычное использование анестезиологической камеры не в лучшую сторону для вашего пациента или персонала
интерес. Так как же отучиться от камеры и перейти к более терпеливым и терпеливым?
удобная для персонала инъекционная стратегия?
Это вопрос выбора времени, оборудования и лекарств.С жесткими кошками в 100 раз легче справиться, если у вас есть хорошо продуманная комбинация успокаивающего / обезболивающего, приготовленная заранее. Ты
сгоняйте кошку в смотровую, как только она войдет в тренировочную дверь.
Убедитесь, что в комнате всегда есть диффузор Feloway. Снимите верх
переноски, накройте кошку полотенцем Feloway, плотно прижмите ее сверху, поднимите заднюю крышку и
ввести комбинацию в эпаксиальные мышцы внутримышечно, прежде чем он / она узнает
что произошло.Затем затемните и выйдите из комнаты. Повторите попытку через 5–10 минут
но также попросите хозяина открыть дверь, если кошка рано начнет спать.
Если они в клетке, используйте Wild Child или EZ Nabber, чтобы собрать их,
сделайте эпаксиальную внутримышечную инъекцию (убедитесь, что добавлено несколько мг / кг кетамина)
если они все завелись) и отпустите их, чтобы расслабиться. Накройте клетку полотенцем Feloway и убедитесь, что подстилка в клетке
Распылите на нее Feloway.
Если они здоровы, я использую буторфанол 0.2 мг / кг безболезненно
процедурная седация ИЛИ гидроморфон 0,1 мг / кг при выполнении болезненного
процедура. Я комбинирую один из этих двух опиоидов с мидазоламом 0,2 мг / кг И
(dex) medetomiidne. Диапазон доз медетомидина составляет от 0,002 до 0,015 мг / кг.
Диапазон доз дексмедетомидина составляет от 0,001 до 0,0075 мг / кг. Я НЕ люблю использовать
ацепромазин при ведении таких пациентов.
Если они абсолютные убийцы, особенно если они уже заведены,
Я добавляю от 1 до 3 мг / кг кетамина.
Если это кардиологические пациенты, я не принимаю (dex) медетомидин и добавляю
от 1 до 3 мг / кг кетамина к опиоиду и мидазоламу. Исключение составляет
кошка с гипертрофической кардиомиопатией с оттоком левого желудочка
препятствие. Эти пациенты оказались подходящими благодаря включению
(декс) медетомидин. 1
Отлично подходит для беспокойных, но здоровых и здоровых амбулаторных пациентов.
встречи.Амбулаторно я использую буторфанол, мидазолам и (декс) медетомидин.
После этого мы вводим атипамезол в / м в дозе 1/2 (dex) медетомидина и
они обычно готовы к раскатке через 10 минут. Часто владельцы рассказывают мне, как
счастливы, что они были с этим сострадательным отношением к пациентам, заявив, что
кошки часто бывают очень нежными после этих седативных явлений.
Подкожное введение жидкости кошкам
Ваш ветеринар определит подходящее количество подкожной жидкости для введения в зависимости от веса и состояния вашей кошки.Используется раствор Рингера, он может быть дополнен витаминами, минералами, электролитами или другими веществами, которые ветеринар сочтет необходимыми. Раствор следует хранить в прохладном месте, защищенном от света, и по возможности применять при комнатной температуре. Кошки с ХПН будут нуждаться в этом лечении регулярно, от одного раза в неделю до ежедневного.
При введении жидкости под кожей накапливается комок жидкости, который в течение следующих нескольких часов будет поглощен телом вашей кошки.Существует множество методов, используемых для введения жидкости под кожу вашей кошки.
Шприцевой метод
Шприцевой метод используется, когда быстро требуется небольшое количество жидкости или когда требуется контроль точного количества и скорости введения, например, при наличии сердечного заболевания. Может потребоваться помощь помощника, чтобы удержать кошку во время процесса. Жидкости набираются из мешка с жидкостью с помощью большого шприца, игла-бабочка вводится под кожу, шприц прикрепляется к игле, и жидкости вводятся через шприц кошке.Если требуется более одного шприца, шприц будет отсоединен от иглы, а другой шприц с жидкостью присоединен к игле, чтобы избежать необходимости в нескольких проколах.
Метод подачи набора
Метод подачи набора требует мешка с раствором, прикрепленного к пробирке, который имеет устройство регулировки объема / блокировки, прикрепленное к трубке, и иглу на другом конце трубки. Трубка должна быть плотно вставлена в пакет с закрытым замком, замок имеет ролик, который можно отрегулировать, чтобы перекрывать или открывать трубку и контролировать поток жидкости.Замок будет открыт, жидкость будет выпущена для удаления пузырьков воздуха и прикрепленной иглы. При обращении с этим устройством важно, чтобы концы трубки не касались чего-либо, поскольку они стерильны и должны оставаться таковыми. Игла вводится в дряблую кожу лопаток или тазовых костей справа или слева от средней линии. Иглу следует вставлять острым концом в сторону головы кошки и горизонтально по отношению к поверхности кожи.Игла будет вставлена аккуратно, но надежно в рулон кожи вашей кошки, а затем защелка на трубке будет снята, чтобы позволить течь жидкости. Процедура займет от 10 до 15 минут, поэтому важно, чтобы ваша кошка находилась в удобном положении, а помощники могли при необходимости удержать кошку. Сумка должна быть поднята примерно на 1 метр над головой вашей кошки. Можно сделать выбор подавать жидкость в двух местах, чтобы не было большого скопления жидкости в одном месте.Обычно средняя кошка получает 100–150 мл жидкости за один прием. После введения жидкости замок закроется, и игла будет удалена. Игла должна быть закрыта колпачком, чтобы не было опасности укола иглой. Если набор будет использоваться снова, новую иглу следует поставить на набор сразу после использования.
Катетеры и кожные пуговицы
При хронических состояниях, требующих постоянного лечения, катетеры или кожные пуговицы могут быть рассмотрены, чтобы исключить необходимость в повторных введениях иглы.Катетер можно ввести подкожно и зафиксировать на месте, пока ваша кошка находится под наркозом, что позволит подключать суб-q жидкости непосредственно к катетеру и вводить без введения иглы. Это более инвазивная процедура, и при использовании этого метода существует риск инфицирования, закупорки или раздражения кожи вашей кошки.
Еще один метод введения жидкостей sub-q — использование «кожной кнопки».
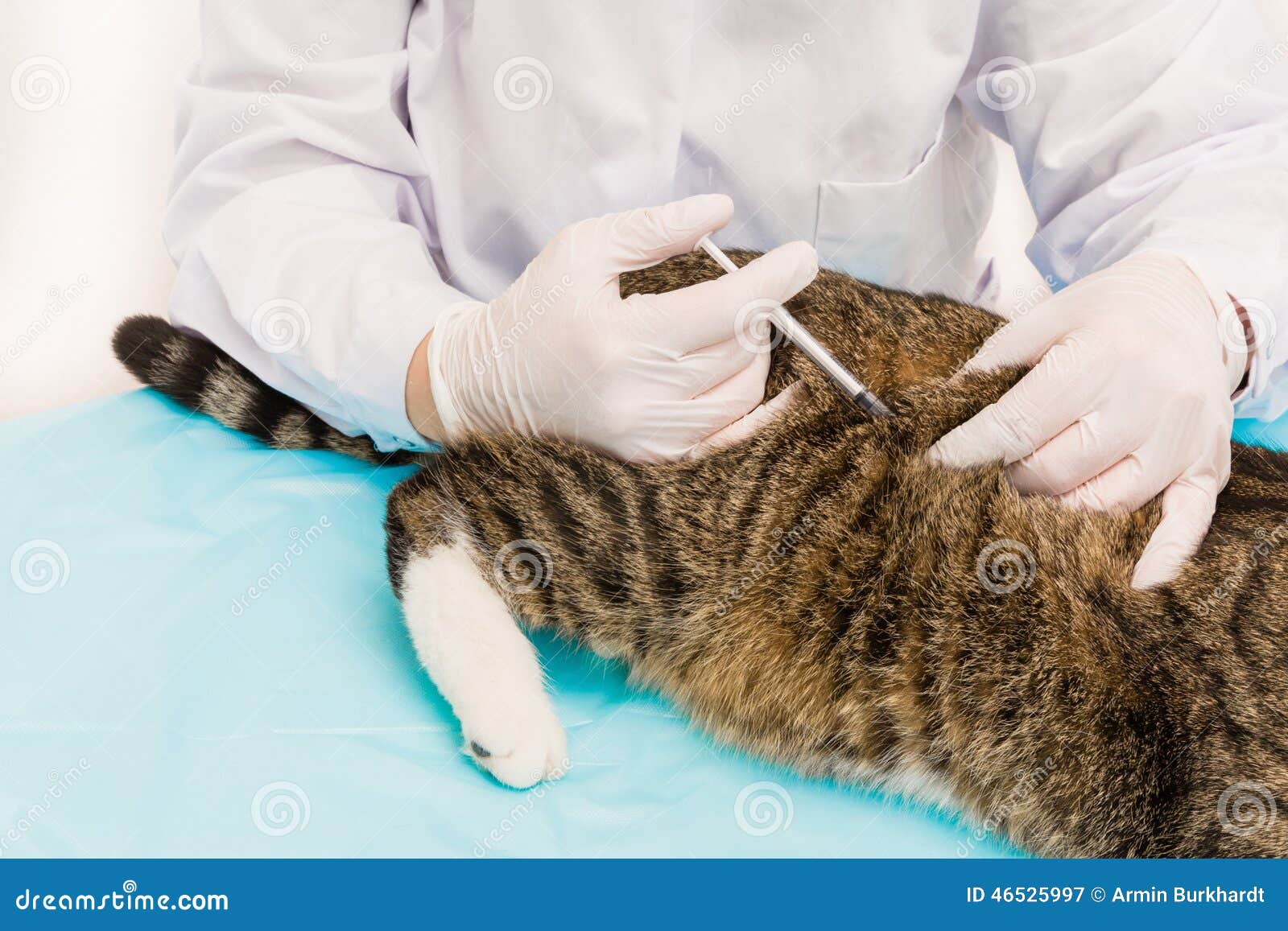 Достичь этого можно, если заранее достать флакон (за 2-3 часа до процедуры) или согреть его в теплой воде. Если этим правилом пренебречь и ввести холодный раствор, велика вероятность образования труднорассасываемых инфильтратов.
Достичь этого можно, если заранее достать флакон (за 2-3 часа до процедуры) или согреть его в теплой воде. Если этим правилом пренебречь и ввести холодный раствор, велика вероятность образования труднорассасываемых инфильтратов.
 Она будет громко выражать недовольство и попытается сбежать любыми способами. Поэтому ветеринары советуют перед уколами обязательно стричь когти и надежно фиксировать даже очень спокойного кота.
Она будет громко выражать недовольство и попытается сбежать любыми способами. Поэтому ветеринары советуют перед уколами обязательно стричь когти и надежно фиксировать даже очень спокойного кота.
 Эти аксессуары сейчас широко представлены в зоомагазинах и пользуются популярностью среди владельцев. Они крепятся на суперклей и срезаются ежемесячно по мере отрастания когтей. К тому же это отличное средство для защиты мебели, царапать которую кошке будет неудобно.
Эти аксессуары сейчас широко представлены в зоомагазинах и пользуются популярностью среди владельцев. Они крепятся на суперклей и срезаются ежемесячно по мере отрастания когтей. К тому же это отличное средство для защиты мебели, царапать которую кошке будет неудобно.

 Лучше всего, если мышца будет не сильно напряжена, в этом случае она немного подвижна и сможет отодвинуться от кости. И к тому же сильно сжатую мышцу очень трудно проколоть иглой.
Лучше всего, если мышца будет не сильно напряжена, в этом случае она немного подвижна и сможет отодвинуться от кости. И к тому же сильно сжатую мышцу очень трудно проколоть иглой. Место инъекции нужно растереть ваткой или помассировать рукой.
Место инъекции нужно растереть ваткой или помассировать рукой.
