Мексидол-Вет для кошек и собак — инструкция по применению
- 29.07.2019
- 224 просмотров
Мексидол-Вет выпускают российское предприятие «Фармасофт — ЗиО-Здоровье».
Действующее вещество — мексидол (этилметилгидроксипиридина сукцинат). Терапевтические формы — раствор для инъекций и таблетки. Препарат Мексидол Вет — это ветеринарный аналог медицинского препарата «Мексидол».
Содержание
- 1 Фармакологическое действие и аналоги
- 2 Назначение и правила хранения
- 3 Мексидол-Вет для инъекций
- 4 Мексидол-Вет в таблетках
Фармакологическое действие и аналоги
Действующее вещество защищает мембраны клеток от разрушительного влияния свободных радикалов. Улучшает использование кислорода. Предотвращает развитие судорог, повышает устойчивость к стрессам. Способствует скорейшему выведению токсинов из организма. Препятствует слипанию тромбоцитов, нормализует обмен холестерина и мозговое кровообращение.
Альтернатива Мексидолу-Вет — медицинские препараты:
- Мексидол;
- Мексикор;
- Мексибел;
- Мексидант.
Назначение и правила хранения
Мексидол-Вет назначают кошкам и собакам в следующих ситуациях:
- сердечная недостаточность;
- интоксикации при гнойном расплавлении тканей;
- дерматиты, трофические язвы, экзема;
- облегчение выхода из наркоза, реабилитация после операций либо травм;
- нарушение мозгового кровообращения;
- профилактика эпилептических припадков;
- расстройства возрастного характера;
- экстремальные нагрузки, транспортировка, участие в соревнованиях;
- перед выставками для улучшения внешнего вида шерстного покрова.
Препарат в таблетках и в инъекционной форме хранят 3 года при температуре от 2 до 25 °С.
Мексидол-Вет для инъекций
Препараты для парентерального введения представляют собой бесцветные или желтоватые прозрачные жидкости, содержащие 2,5 или 5% этилметилгидроксипиридина сукцината. Расфасованы в ампулы по 1; 2; 5 мл.
Расфасованы в ампулы по 1; 2; 5 мл.
Стоимость ампулы 2 мл 5% раствора в июле 2019 г. — 43 р
Продолжительность лечения, кратность инъекций, а также разовую дозировку корректирует ветеринарный врач. Лекарство вводят внутримышечно или внутривенно. В последнем случае содержимое ампулы разводят водой для инъекций либо физраствором не менее чем в 2 раза. Дозируют препарат в соответствии со схемой:
| Назначение | Дозировка | Количество инъекций в сутки | Продолжительность лечения, дней | ||
| мг/кг веса | мл 2,5% раствора/кг | мл 5% раствора/кг | |||
| Острый воспалительный процесс | 5 | 0,2 | 0,1 | 1 | 5–15 |
| Профилактика наркозных осложнений | 10–15 | 0,4–0,6 | 0,2–0,3 | 2 | 2–3 дня до и после операции |
| При длительном наркозе | 20 | 0,8 | 0,4 | дробно | во время операции |
| Для улучшения самочувствия после 7 лет | 10 | 0,4 | 0,2 | 3 | 5–7 дней с ежеквартальным повторением |
В начальном периоде лечения острых воспалительных заболеваний разовую дозу ветеринарный врач увеличивает по своему усмотрению в 2–3 раза.
Мексидол-Вет в таблетках
Выпускают коробки по 20 таблеток, содержащих 50 или 125 мг действующего вещества. Пилюли белого с кремовым оттенком цвета разделены риской.
Стоимость 20 таблеток по 50 мг в июле 2019 г. — 275 р.
Пилюли дают после кормления. Продолжительность лечения, количество таблеток в сутки корректирует ветеринарный врач в соответствии со схемой:
| Назначение | Разовая доза, мг/кг | Кратность приема в сутки | Курс лечения, дней | Дополнительно |
| Острое воспаление | 5–7,5 | 1 | 5–15 | В первые дни дозу увеличивают вдвое |
| Сердечно-сосудистая недостаточность | 10–15 | 2–3 | 7–10 | Разовую дозу снижают вдвое, дают 10–14 дней |
| Хронические заболевания | 5–7,5 | 2 | 21 | Повторяют лечение 1–2 раза в полугодие |
| Профилактика наркозных осложнений | 5–7,5 | 2–3 | 2–3 дня до наркоза | 2–3 дня после наркоза |
| Участие в экспертной выставке, транспортировка | 5–7,5 | 2–3 | 3–5 дней до наркоза |
Питомцам, перешагнувшим семилетний рубеж, рекомендуется принимать Мексидол-Вет из расчета 5 мг/кг дважды в день курсами по 2–4 недели ежеквартально.
Автор: Кулешов Е. И. (ветеринар, доцент, кандидат сельскохозяйственных наук)
ЗиО-Здоровье
Редакция сайта категорически не рекомендует заниматься самостоятельным лечением животных! Информация о ветеринарных препаратах, опубликованная на сайте, предназначена для специалистов. Самостоятельное лечение животных, описанными препаратами, может нанести вред. Обязательно консультируйтесь с ветеринарными врачами в очной форме перед применением препаратов.
Отзывы
Разработка методов лечения и
Профилактика нарушений репродуктивной функции
животных из-за использования современных инсектицидов в
Животноводство
Салимова Ирода Юнусовна*
* Автор, ответственный за переписку: Салимова Ирода Юнусовна, научный сотрудник, Самаркандский институт ветеринарной медицины, Самарканд, Узбекистан.
Получено: 10 ноября 2021 г .; Опубликовано: 22 ноября 2021 г.
DOI: 10.34297/AJBSR.2021.14.002042
Резюме
В статье представлены методы терапии и профилактики репродуктивных дисфункций у животных вследствие нерационального применения современных
инсектоакарициды.
Ключевые слова: Синтетический перитроид, Эсфенвалерат, Репродуктивная функция, Иммуномодулятор, Антиоксидант
Введение
В настоящее время в Узбекистане используется ряд инсектицидов
для защиты сельскохозяйственных животных и птицы от различных эктопаразитов-
переносчики возбудителей опасных инфекций и инвазий,
и более 80% из них представлены препаратами из
группа синтетических пиретроидов (СП).
Синтетические пиретроиды отличаются широким спектром действия
активность против вредителей, отсутствие фитотоксичности, высокий индекс безопасности для
человек и теплокровные животные, низкая живучесть и опасность
рекомендуемых дозировок для окружающей среды и полезных
организмов [1-3,5,10-12,14].
Основным преимуществом веществ этой группы является их высокая
инсектицидное и акарицидное действие с выраженной избирательностью
действия, что во много раз превышает селективность ФОС.
Поэтому пиретроиды применяют в очень малых количествах — сотни
граммов на гектар. Однако эти соединения неустойчивы.
при использовании в сельском хозяйстве и ветеринарии они могут получить
в окружающую среду и вызывают отравление людей и животных
[1,5,8,16].
Это указывает на необходимость постоянного совершенствования систем
принципы изучения взаимодействия экотоксикантов с
организма продуктивных животных в репродуктивном цикле, уточняя
молекулярная природа нарушений генеративной функции в
общие, прогнозирование и ранняя диагностика их нарушений, поиск
за рациональные пути и системы профилактики, эффективной дезинтоксикации
(фармакологическая коррекция), особенно в сторону
повышение иммунобиологической устойчивости к химическим антропогенным
воздействие [21,23,28].
В то же время следует отметить отсутствие эффективных
методы корригирующей терапии этих нарушений.
В связи с этим основной целью нашего исследования было
разработать методы терапии и профилактики нарушений
репродуктивной функции животных из-за нерационального применения современных инсектоакарицидов в практике животноводства в
Узбекистан.
Материалы и методы исследования
В работе использовали
лабораторных животных – кроликов. синтетический
пиретроид «эсфенвалерат» в виде 0,03% инсектицида
порошок (пыль), рекомендованный для химиопрофилактического лечения
сельскохозяйственных животных против эктопаразитов использовали как средство
что может негативно сказаться на репродуктивной функции
животные.
На основании известной информации о механизмах
токсическое действие пиретроидов на организм животных, препараты
В качестве возможных средств использовались «Гамавит», «Фоспренил» и «Мексидол».
фармакологической коррекции репродуктивных нарушений у животных
под влиянием эсфенвалерата.
При оценке возможного отрицательного действия эсфенвалерата
пыли на репродуктивную функцию кроликов мы руководствовались
методические рекомендации, разработанные И.В. Саноцким,
В.Н. Фоменко и др.; О Н Елизарова; Н. И. Жаворонков; А А
Динерман; Загольников С.Д. и др. [8-10,17,25,29].
Опыты проведены на 12 половозрелых кроликах.
(6-7 месяцев, 9 самок и 3 самца) были разделены на три
идентичные группы, по 3 самки и 1 самец в каждой. За 7 дней спаривания,
всем подопытным кроликам вводили Гамавит и Мексидолад
повторно, внутримышечно в дозах 0,1 мл/кг живой массы,
соответственно.
Кролики первой группы (самки) при случке и
беременности еженедельно подвергались кожному воздействию до 0,031%
эсфенвалератной пыли в количестве 20 г/гол. Кроме того, 0,1
вводили мг/кг Гамовита и 10 мг/кг Мексидола
внутримышечно им еженедельно.
Применение присыпки было прекращено после родов, и препаратов
были прекращены после того, как полученное потомство достигло возраста
1 месяц.
Кролики второй группы также в период спаривания
и на протяжении всей беременности подвергались кожному воздействию
к перитроидной пыли в дозе 20 г/гол, но не получал
профилактическое лечение. Подопытные кролики третьей группы
служили контролем, они не подвергались воздействию пыли и лекарственных
подготовка к полученному потомству в течение месяца, наблюдения
были сделаны: его численность, рост и развитие, а также гибель
на разных этапах постнатального онтогенеза.
Результаты и обсуждение
Все подопытные животные оплодотворены, без патологических
нарушения наблюдались во время беременности; период беременности в
кроликов в среднем 30-31 день (табл. 1, 2, 3), после чего им давали
соответствующее потомство, некоторые его количественные и качественные
показатели также представлены в этих таблицах.
Таблица 1: Показатели воспроизводительной функции кроликов контрольной группы.
Таблица 2: Показатели репродуктивной функции кроликов при еженедельном накожном воздействии 0,03% дуст-эсфенвалерата в дозе 20г/гол.
Таблица 3: Показатели репродуктивной функции кроликов при еженедельном накожном воздействии и 0,03% дуста-эсфенвалерата в дозе 20г/гол.
лечили препаратами «Гамавит» и «Мексидол».
Как видно из материалов этих таблиц, самки
подвергшихся во время беременности кожному воздействию 0,03% пыли
на основе синтетического пиретроида эсфенвалерата в дозе 20 г/сут.
голова дала несколько большее потомство по сравнению с контролем и
группа однотипных самок, подвергшихся воздействию пыли и
лечили «Гамавитом» и «Мексидолом». Однако среди родившихся
Однако среди родившихся
кроликов от вышеуказанных самок было зарегистрировано два случая
мертворождений (табл. 1).
Кроме того, в первую неделю после рождения еще три крольчата
умерло от потомства самок, не леченных этими препаратами,
что свидетельствует о неблагоприятном влиянии пыли эсфенвалерата на
их репродуктивной функции и нецелесообразности проведения
химиопрофилактические обработки животных во время беременности.
Результаты, представленные в таблице 6. свидетельствуют о высоком защитном действии
препаратов «Гамавит» и «Мексидол» для репродуктивной функции
женщин, получавших эсфенвалерат во время беременности. Там
также не оказывало отрицательного влияния на рост и жизнеспособность
потомства в ранний период постнатального онтогенеза.
Таким образом, лечение животных (кроликов) от различных
эктопаразитов с применением синтетических пиретроидов при
беременность оказывает негативное влияние, проявляющееся появлением
мертворожденного потомства, снижение его выживаемости и низкий рост
динамика в ранние периоды постнатального онтогенеза.
Анализируя результаты исследований, можно сделать вывод, что
химиопрофилактическая обработка животных от паразитарных
членистоногих (клещи, блохи, вши) пиретроидом эсфенвалератом, в
дозы и концентрации, не вызывающие проявления
видимые клинические симптомы интоксикации, отрицательно сказываются на
беременное тело. Отрицательный эффект проявляется в увеличении
случаев мертворождения и послеродовой смерти новорожденных
молодой, низкая динамика его роста и развития.
Для успешной коррекции этих нарушений необходимо
использовать иммуномодулирующие средства Т-типа (гамавит, полиоксидоний,
димефосфон и др.) при беременности животных, а также лекарственные
с антигипоксическими, антиоксидантными и мембранопротекторными свойствами
(мексидол, мексидол-вет).
Выводы
а. Мертворождение среди потомства (мышей) от самок при воздействии
при беременности до 0,03% достомесфенвалерата, составляет 33%, а
постнатальная смертность достигает 23%.
б. Мертворождение среди потомства (кроликов) от леченных самок
при беременности 0,03% пылью на основе пиретроидов
эсфенвалерата составляет в среднем 12%, а их выживаемость в первые
2 неделя послеродового периода 78-79% (постнатальная смертность —
21-22% соответственно).
с. Для предупреждения случаев мертворождения и гибели потомства в
ранние периоды постнатального онтогенеза, использование природного
иммуномодулятор «Гамавит» и антиоксидант, мембранный
протектор – показан «Мексидол». В то же время «Гамавит»
применяют при беременности еженедельно, внутримышечно, в дозах от
от 0,05 до 0,1 мл/кг, а «Мексидол» — 1 раз в 10-14 дней,
внутримышечно в дозе 5 мг/кг массы животного.
д. Наибольшее защитное действие на организм беременных крольчих.
е. При химиопрофилактическом лечении пиретроидами от
различные эктопаразиты (клещи, вши, блохи) иммуномодулятор
Предоставляется «Гамавит».
Каталожные номера
- Аббасов Т.Г. (2004) Токсикологическая характеристика пыли на основе перметрина и хлорофоса. Проблемы ветеринарной санитарии, гигиены и экологии 116: 232-239.
- Бардов В.Г., Леоненко О.Б., Омельчук С.Т., Сасинович Л.М. (1999) Процессы свободнорадикального окисления липидов в механизме действия синтетических пиретроидов.
 Современные проблемы токсикологии 1: 37-43.
Современные проблемы токсикологии 1: 37-43. - Галяутдинова Г.Г. и др. (2005) Токсикологические аспекты применения синтетических пиретроидов в сельском хозяйстве. Ветеринария 5: 52-56.
- Герунов Т.В. (2009) Иммунотоксические эффекты синтетических пиретроидов и возможности их фармакокоррекции у животных: Дисс. Доктор Ветнаук, Омск.
- Жаворонков Н.И. (1979) Оценка влияния пестицидов на репродуктивную функцию животных. Ветеринария 9: 67-69.
- Кашин А.С., Оспищев А.В., Москвитина М.С. (2010) Особенности действия экотоксикантов на репродуктивную функцию продуктивных животных – Красноярский государственный аграрный университет, Красноярск, Россия.
- Кокшарева Н.В., и соавт. (2000) Синтетические пиретроиды: механизм нейротоксического действия, поиск препаратов для лечения острых отравлений. Современные проблемы токсикологии 3: 21-25.
- Леонард Р.А. (2006) Влияние гамавита, фоспренила и максидина на ряд биохимических показателей крови собак с пироплазмозом.
 Ветклиника 3: 2-5.
Ветклиника 3: 2-5. - Санин А.В., Зайцева Л.Г., Киреева И.В., Березина Л.К., Санина В.Ю., и соавт. (2008) Гамавит является антидотной терапией при окислительном стрессе. Ветеринарный доктор 6: 7-8.
- Слободяник В.И. (2005) Эффективность использования фоспренила в производстве крольчатины В.И. Слободяник, С.П. Жуков, М.А. Кустов. Кролиководство и звероводство 5:7-8.
Клинико-лабораторные проявления миокардита у собак
КНЭ Науки о жизни
/
Международная научно-практическая конференция «АгроСМАРТ – умные решения для сельского хозяйства»
/
Стр. 820–832
Ведущими клиническими признаками миокардита у собак были внезапное развитие признаков заболевания, отказ от еды, одышка в покое, быстрая утомляемость. На диагностическом этапе положение животных вынужденное, лежачее, учащение дыхания до 60-72 движений в минуту, бледность видимых слизистых оболочек и конъюнктивы, слабое наполнение пульса, быстрое наполнение капилляров, повышение артериального давления, увеличение количества лейкоцитов до 25–27×109/л, СРС до 15,4–17,4 мг/л, тропонин до 3,85–4,2 нг/мл. При электрокардиографическом исследовании установлен синусовый или эктопический ритм, частота сердечных сокращений 133–198 унций/мин, нарушение проводимости и замедление. ЭХОКГ показало умеренное расширение левого желудочка, умеренное расширение левого предсердия. Герметизация створок митрального клапана, регургитация на митральный клапан первой степени. Миокард левого желудочка неоднороден, эхогенность стенок повышена. Фракция сократимости 16–18 %. После установления режима питания и коррекции условий содержания, собакам строго с двенадцатичасовым интервалом дважды в сутки назначают ведмедин (0,25 мг/кг), соталол (1,5 мг/кг), синулокс ( 20 мг/кг), мексидол-вет (1 табл.), веросферон (1 мг/кг). В результате четырехнедельного наблюдения за состоянием больных отмечены положительные результаты: отсутствие одышки, нормализация частоты пульса и АД, снижение скорости наполнения капилляров до 1 секунды, концентрация лейкоцитов до 12,6–15,7. ×109/л, СРС до 1,3–1,4 мг/л, тропонин до 0,09–0,17 нг/мл.
При электрокардиографическом исследовании установлен синусовый или эктопический ритм, частота сердечных сокращений 133–198 унций/мин, нарушение проводимости и замедление. ЭХОКГ показало умеренное расширение левого желудочка, умеренное расширение левого предсердия. Герметизация створок митрального клапана, регургитация на митральный клапан первой степени. Миокард левого желудочка неоднороден, эхогенность стенок повышена. Фракция сократимости 16–18 %. После установления режима питания и коррекции условий содержания, собакам строго с двенадцатичасовым интервалом дважды в сутки назначают ведмедин (0,25 мг/кг), соталол (1,5 мг/кг), синулокс ( 20 мг/кг), мексидол-вет (1 табл.), веросферон (1 мг/кг). В результате четырехнедельного наблюдения за состоянием больных отмечены положительные результаты: отсутствие одышки, нормализация частоты пульса и АД, снижение скорости наполнения капилляров до 1 секунды, концентрация лейкоцитов до 12,6–15,7. ×109/л, СРС до 1,3–1,4 мг/л, тропонин до 0,09–0,17 нг/мл. Электрокардиографическое исследование показало уменьшение высоты зубцов R и P, увеличение интервалов P-Q и Q-T. Синусовый ритм нерегулярный. На ЭхоГГ расширение левого желудочка, умеренное расширение левого предсердия. Герметизация створок митрального клапана, регургитация на митральный клапан первой степени. Миокард левого желудочка менее неоднороден, эхогенность стенок повышена. Фракция сократимости 23–24 %. Исход заболевания на этой стадии предсказать сложно, так как возраст собак составляет 7–12 лет, и качество жизни во многом будет обеспечиваться их владельцами.
Электрокардиографическое исследование показало уменьшение высоты зубцов R и P, увеличение интервалов P-Q и Q-T. Синусовый ритм нерегулярный. На ЭхоГГ расширение левого желудочка, умеренное расширение левого предсердия. Герметизация створок митрального клапана, регургитация на митральный клапан первой степени. Миокард левого желудочка менее неоднороден, эхогенность стенок повышена. Фракция сократимости 23–24 %. Исход заболевания на этой стадии предсказать сложно, так как возраст собак составляет 7–12 лет, и качество жизни во многом будет обеспечиваться их владельцами.
[1] Благова О.В. (2014). Не доступный. Современные маски миокардита (от клинических синдромов к диагностике). Российский кардиологический журнал, вып. 5 (100), стр. 13–22. Москва: ООО «ФИРМА СИЛИЦИЯ».
[2] Болезни собак и кошек. Комплексная диагностика и терапия. (2013). Под редакцией Стекольниковой А.А., Староверова С.В. 4-е изд., соч. и доп. СПб.: СпецЛит, 925 с.
[3] Васильева В.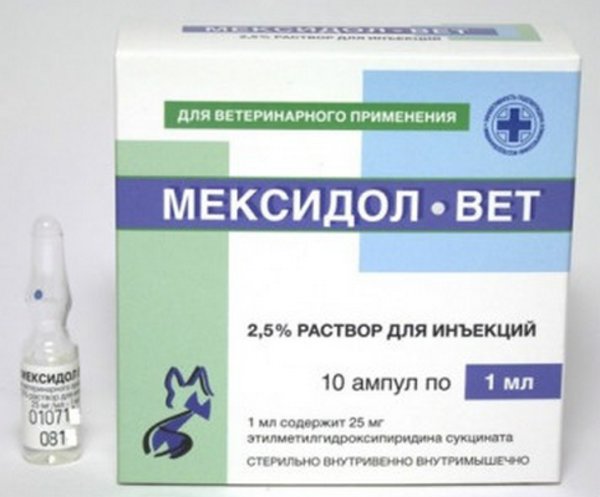 А., Прохорова Е.В., Куликова Н.Н., Небайкина Л.А. (2006). Лечение миокардита у собак. Успехов современной науки нет. 1, стр. 48–49.. Белгород: Успехи современной науки.
А., Прохорова Е.В., Куликова Н.Н., Небайкина Л.А. (2006). Лечение миокардита у собак. Успехов современной науки нет. 1, стр. 48–49.. Белгород: Успехи современной науки.
[4] Герке В.С. (2013). Основы кардиологического обследования собак. Ветфарма, нет. 4, стр. 40–46. Москва: Медицинское информационное агентство «МЕДФОРУМ».
[5] Гиляровский С.Р. (2008). Миокардит: современные подходы к диагностике и лечению. Москва: Медиасфера, 324 с.
[6] Голохваст К.С., Паничев А.М., Автомонов Э.Г. (2010). Экологические аспекты взаимодействия живых организмов с минеральными факторами окружающей среды. Материалы II Международного симпозиума «Экологические проблемы животных и человека». (Министерство сельского хозяйства РФ, Новосибирский государственный аграрный университет, НИИ животноводства, Биотехнологический институт, 29–30 октября 2009 г.). Новосибирск, стр. 25–27.
[7] Донник И.М., Шкуратова И.А. (2011). Окружающая среда и здоровье животных. Ветеринария Кубани, Краснодар: Краснодарская краевая общественная ветеринарная организация, вып. 2, стр. 12–13.
2, стр. 12–13.
[8] Юликова О.А. (2016). Мониторинг сердечно-сосудистых заболеваний среди кошек и собак в г. Благовещенске Амурской области. Дальневосточный аграрный вестник. Благовещенск: ФГБОУ «Дальневосточный государственный аграрный университет». 2(38), стр. 49–56.
[9] Иванова С.В., Титов В.А., Митрофанова Л.Б., Моисеева О.М. (2018). Анализ причин поздней диагностики миокардита. Трансляционная медицина, нет. 5(2), стр. 5–14. Санкт-Петербург: Национальный медицинский исследовательский центр им. В.А. Алмазов.
[10] Исаков Л.К., Тарасов Н.И., Синькова М.Н., Ваховская И.М. (2017). Клинический случай благоприятного исхода недиагностированного миокардита. Фундаментальная и клиническая медицина, т. 1, с. 2, стр. 83–91. Кемерово: ФГБОУ ВО «Кемеровский государственный медицинский университет».
[11] Козловская Н.Г. (2013). Породная предрасположенность собак и кошек к кардиологическим заболеваниям. РЖС. МВА, № 6, с. 32–35. Москва: Логос-Пресс.
[12] Королева А. А., Журавков Ю. Л. Современные подходы к диагностике и лечению миокардита ///C:/Users/%D0%9B%D1%D1%E%D0%B4%D0%D0%BC%D0%B8%D0%B%D0%B0/Downloads/2013011410411110.pdf (оценка 07.02.2019).
А., Журавков Ю. Л. Современные подходы к диагностике и лечению миокардита ///C:/Users/%D0%9B%D1%D1%E%D0%B4%D0%D0%BC%D0%B8%D0%B%D0%B0/Downloads/2013011410411110.pdf (оценка 07.02.2019).
[13] Мартин В.С., Коркорин Б.М. (2004). Кардиореспираторные заболевания собак и кошек. Москва: Аквариум-Принт, 496 с.
[14] Мартынов А.Н., Турков В.Г., Клетикова Л.В., Зыбина Т.Н. (2016). Сахарный диабет у кошек, ассоциированный с метаболическим синдромом. Успехи современной науки, т. 1, с. 3, нет. 2, стр. 6–11. Белгород.
[15] Митьковская Н.П., Григоренко Е.А., Данилова Л.И. (2008). Сердечный и метаболический риск. Минск: Беларусь. Наука, 277 с.
[16] Ниманд, Х.Г., Саутер, П.Ф. (2001). Болезни собак. Практическое руководство для ветеринарных врачей (организация ветеринарной клиники, обследование, диагностика болезней, лечение), 2-е изд. Москва: ООО «Аквариум», 816 с.
[17] Палеев Н.Р., Палеев Ф.Н. (2009). Некоронарогенные заболевания миокарда и их классификация. Российский кардиологический журнал, вып. 3(77), стр. 5–9. Москва: ООО «ФИРМА СИЛИЦЕ».
3(77), стр. 5–9. Москва: ООО «ФИРМА СИЛИЦЕ».
[18] Роберто, А. Сантилли. (2017). Этиология миокардита. Терапевтические стратегии. Что мы можем использовать в клинической практике и как интерпретировать биопсию миокарда. Ветфарма, нет. 3. Москва: Агентство медицинской информации МЕДФОРУМ.
[19] Рогачев А.С. (2015). Диагностическое исследование крови на содержание сердечных тропонинов. РВВ. МВА, нет. 1, стр. 32–33. Москва: Логос Пресс.
[20] Руденко А.А. Распространение кардиомиопатий и других сердечно-сосудистых заболеваний у собак. Получено с: http://xn--80abelqjzx5d.su/rasprostranenie-kardiomiopatiji-drugih-boleznej-serdechno-sosudistoj-sistemy-u-sobak.html (дата обращения: 08.02.2019).
[21] Swanton, H., Harband, R.K. (2001). Диагностика и лечение миокардита. Получено с: https://www.lvrach.ru/2001/07/4528851/ (дата обращения: 04.02.2019).).
[22] Скворцов В.В., Тумаренко А.В., Одинцов В.В., Орлов О.В., Скворцова Е.М. (2009). Российский кардиологический журнал, вып. 1(75), стр. 87–96. Москва: ООО «ФИРМА СИЛИЦЕ».
1(75), стр. 87–96. Москва: ООО «ФИРМА СИЛИЦЕ».
[23] Современный курс ветеринарии Кирка. (2005). Москва: Аквариум-Принт, 1376 с. [24] Старченков, С.В. (2001). Болезни собак и кошек. СПб.: Лань, 560 с. [25] Сторожков Г.И., Горбаченков А.А. (2008). Руководство по кардиологии, вып. 1. Москва: Геотар-Медиа, 682 с.
[26] Suther, P., Kon, B. (2011) Болезни собак, 10-е изд., полная переработка и расц. Москва: Аквариум-Принт, 1384 с.
[27] Хрущева В.П., Шумаков В.В., Мартынов А.Н., Клетикова Л.В. (2017). Анализ заболеваемости сердечно-сосудистой патологией у мелких домашних животных за период с 2012 по 2015 год // Аграрный вестник Верхневолжского региона. ФГБОУ ЭТО Ивановская ССХА. 3, стр. 25–31.
[28] Черч, В. М., Сиссон, Д. Д., Ояма, Массачусетс, Захари, Дж. Ф. (2007). Атриовентрикулярная блокада третьей степени и внезапная смерть вследствие острого миокардита у собаки. Дж. Вет. Кардиол., нет. 9. С. 53–57.
[29] Янус И., Нощик-Новак А., Новак М. и соавт. (2018). Биокардит у собак: этиология, клинические симптомы и гистопатологические признаки (обзор 11 клинических случаев: 2007–2013 гг.). Современная ветеринария. Кардиология (специальный выпуск), стр. 34–42. Москва: ООО «НИЦ Зооинформ».
(2018). Биокардит у собак: этиология, клинические симптомы и гистопатологические признаки (обзор 11 клинических случаев: 2007–2013 гг.). Современная ветеринария. Кардиология (специальный выпуск), стр. 34–42. Москва: ООО «НИЦ Зооинформ».
[30] Кеталь, Г. Д. (2005). Уменьшение размера инфаркта и постишемического воспаления за счет ATL-146e, высокоселективного агониста аденозиновых рецепторов A2A, в реперфузированном миокарде собак. Am J. Physiol Heart Circ Physiol, vol. 288 (4), стр. h2851–h2858.
[31] Канэсигэ Т., Мачида Н., Накао С., Дойгучи О., Кацуда С., Ямане Ю. (2007). Полная атриовентрикулярная блокада, связанная с лимфоцитарным миокардитом атриовентрикулярного узла у двух молодых взрослых собак. Дж. Комп. Путь., вып. 137, стр. 146–150.
[32] Mason, J.W., OʼConnell, J.B., Nerskowitz, A. et al. (1995). Клинические испытания иммуносупрессивной терапии миокардита. Н. англ. Дж. Мед. об. 333, стр. 269–275.
[33] Silvestrini, P. et al. (2012). Концентрация сердечного тропонина I в сыворотке у собак с лейшманиозом: корреляция с возрастом и клинико-патологическими отклонениями.
 Современные проблемы токсикологии 1: 37-43.
Современные проблемы токсикологии 1: 37-43.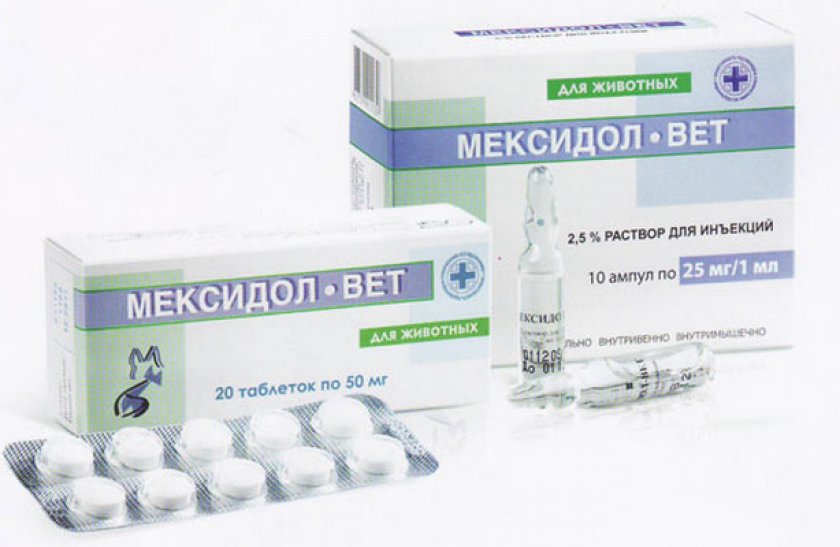 Ветклиника 3: 2-5.
Ветклиника 3: 2-5.